出品:科普中国
作者:郝琪(中国生物工程学会会员、河北工业大学在读博士)
监制:中国科普博览
在肿瘤治疗、自身免疫疾病等领域,医用蛋白制剂正成为无数患者的“救命稻草”。从治疗癌症的单克隆抗体,到拯救糖尿病患者的胰岛素,再到治疗罕见病的酶替代制剂,这些由活细胞“生产”的生物药,凭借精准靶向性改写了许多疾病的治疗史。
但与此同时,它们的价格却让不少患者望而却步:2021年,某个针对淋巴瘤和实体瘤的CAR-T细胞治疗产品上市后不久,就广受社会关注,其治疗费用高达120万元。这些能救命的“蛋白”,为何会卖出“天价”?它们从实验室到患者手中,经历了怎样的旅程?
从“无药可医”到“精准治疗”:医用蛋白制剂的诞生意义
生物药通常是指利用蛋白质、酶、单克隆抗体、疫苗和肽等制备而成的医用制剂,因其高特异性、更高的效力和靶向能力、更低的副作用,在癌症、糖尿病、免疫疾病和传染病等治疗领域脱颖而出。在传统小分子药物时代,许多复杂疾病因难以找到精准靶点而陷入“无药可医”的困境。医用蛋白制剂的出现,打破了这一局限。
从细胞到制剂的“万里长征”
要理解医用蛋白制剂高价的原因,首先要揭开其制备流程的神秘面纱。从研发到生产的全流程,堪称一场“精度与耐心的考验”。
步骤1:找到“生产工厂”并高效运转——大规模发酵/细胞培养
生物药的核心是具有治疗活性的蛋白质,但蛋白质无法直接“合成”,必须依赖活细胞作为“生产工厂”,然后在生物反应器中进行大规模培养。在细胞培养过程中,对环境的要求极高,通常需要维持在相对较高的温度(高于30摄氏度)和中性pH条件下,保持至少十天时间,直到足够的蛋白质合成并分泌至胞外为止。从开始到收获,期间任何微小波动都可能导致细胞死亡或蛋白表达异常。
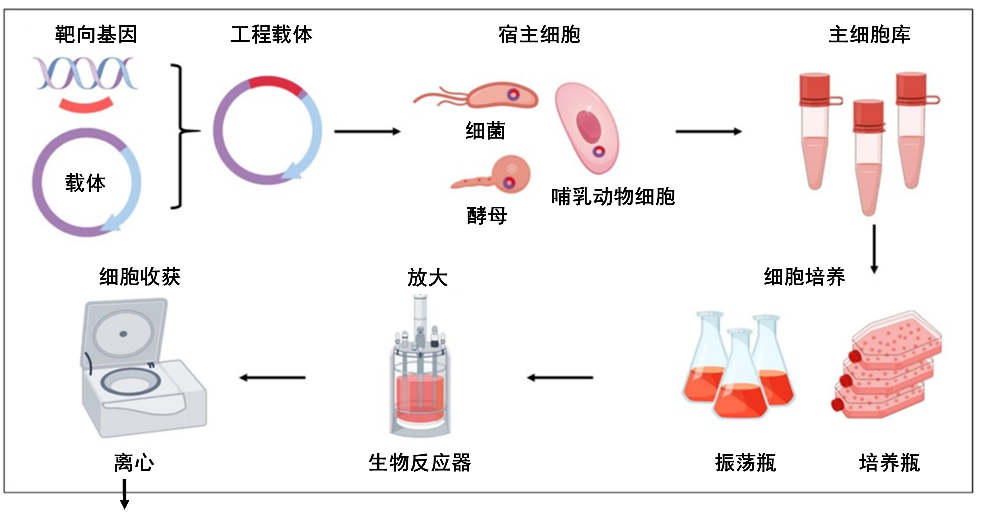
生物制药生产的上游工艺示意图
(图片来源:Advanced Drug Delivery Reviews)
步骤2:“提纯”——从混合物中找到“黄金分子”
细胞培养结束后,培养液中除了目标蛋白,还含有大量杂质(细胞碎片、杂蛋白、病毒等),这对蛋白纯度提出了较高的要求。分离和纯化蛋白质的传统方法是色谱法,往往需要通过多步层析(“类似筛子层层过滤杂质”)及过滤等工艺,**将目标蛋白的纯度提升至99.9%以上——这相当于从1吨混合物中精准提取出1克“纯金”。**与此同时,还面临着色谱法处理能力有限,所用色谱柱耗材价格昂贵的问题,在这个过程中也会产生大量的液体废物,提纯成本较高。
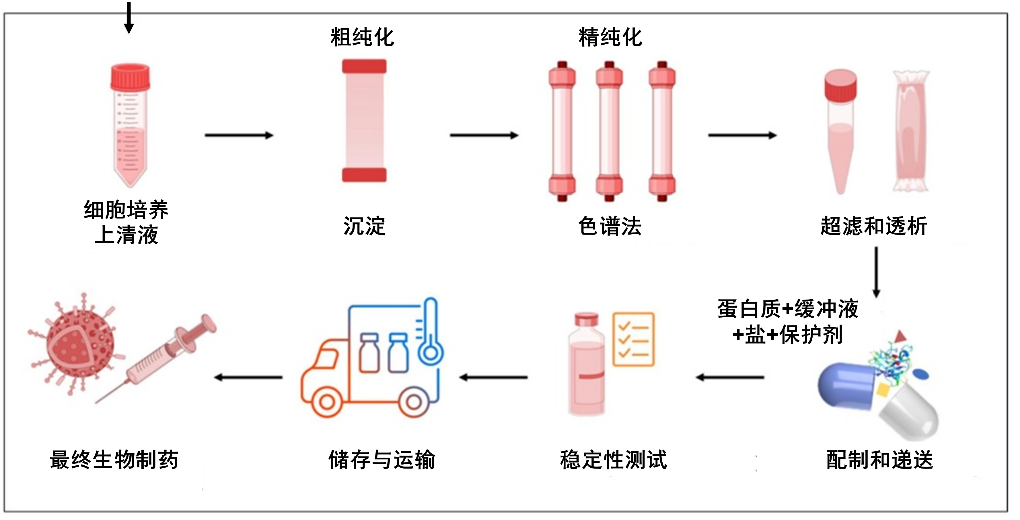
生物制药生产的下游工艺示意图
(图片来源:Advanced Drug Delivery Reviews)
步骤3:制剂与质控——确保“救命药”的安全
提纯后的蛋白需制成稳定的制剂(如注射液、冻干粉),这包括配制与混合、灌装等步骤,还需严格质控:即无菌性、活性、稳定性等数十项检测。在整个生产过程中,蛋白质会经历多种破坏因素,如低pH、高盐、冻融、光照、振荡、剪切等,这些因素都可能会造成蛋白质的结构变化或降解,从而影响生物药的质量。
不仅仅是“生产成本高”
医用蛋白制剂的高价,远非“生产复杂”能完全解释。其背后是多重因素的叠加:
1.研发成本惊人
蛋白质天性“娇弱”,是由数千个氨基酸像串珠子一样连起来的大分子,结构极其复杂——**就像一件精密折叠的丝绸衬衫,稍微遇到高温、震动或酸碱环境,就会“散架”变形,失去药效。**例如单克隆抗体(mAb)分子由多个区域组成,包括两个抗原结合片段(Fab),一个可结晶片段(Fc)和一个铰链区域,分子量达到150千道尔顿(相当于8333倍的水分子量,水的分子量为0.018千道尔顿),分子本身结构复杂,同时其连接Fab和Fc的铰链区域具有较高灵活性。更麻烦的是,溶液中的蛋白质还会“抱团”,**就像人群拥挤时容易扎堆,蛋白质分子也会互相吸附、聚集,形成沉淀。这不仅浪费原料,还可能引发过敏反应。**一款新药从早期研发到临床试验再到上市,投入成本超20亿美元,且药物的临床试验风险较大。
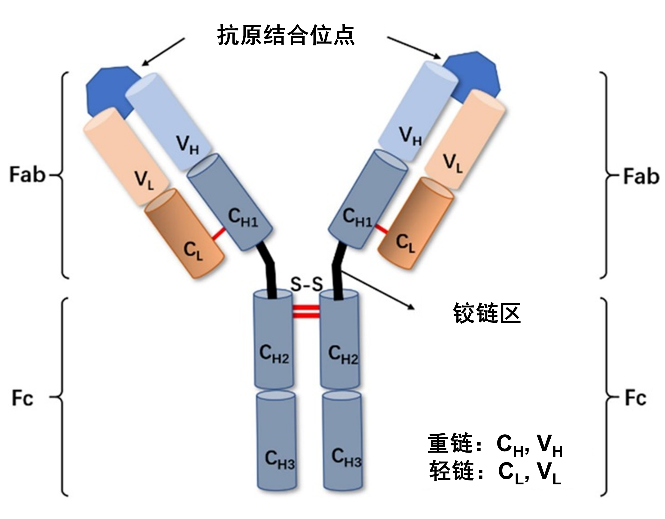
单克隆抗体的一般结构
(图片来源:Separation and Purification Technology)
2.给药手段的挑战
医用蛋白制剂的给药方式,影响着患者的使用体验和治疗成本。总体而言,高于90%的批准生物制剂是侵入性的,包括静脉注射、皮下注射、肌肉注射等。
静脉注射有助于立即和连续地将药物输送到循环系统,但需要在医院由医护人员非常谨慎地调整剂量。肌肉注射是药物在人高度血管化的肌肉内输送,使血液能够均匀快速地吸收并纳入体循环。这种给药方式高达全球注射总量的75%,但可能会引发一些不必要的问题,例如骨膜炎,组织坏死,感染,神经和血管损伤等。
非侵入性药物可以通过以下三种方式给药:局部(包括眼科)、舌下含服或口服。局部给药是这些类型中最常见的(50%),其次是舌下含服(25%)和口服给药途径(25%)。非侵入性药物给药总体上更安全,患者依从性和满意度更高,但实际获批的非侵入性生物制剂数量并没有明显或逐年增加的趋势。例如,口服生物制剂深受患者青睐,但其最具挑战性——保护蛋白质药物免受胃酸和酶的消化、使植物细胞在肠腔内破裂以释放蛋白质药物、将治疗性蛋白质通过肠上皮细胞输送至免疫或循环系统。
基于这些给药方式的限制,如静脉注射的医护人力成本、新型给药技术的研发投入、频繁注射的痛苦与间接损伤等,进一步抬高了生物制剂的成本。
3.储存运输艰难
将生物制剂纯化至纯度高于99%是生物制剂生产中最昂贵的一部分。经过如此大的投入,因生物制剂脆弱的性质,药物保质期很短,需要全程冷链(通常为2-8摄氏度)进行储存和运输,相对普通货车运输耗能巨大,同时这个环节非常不稳定,运输过程中一旦出现温度波动便可能会导致药物失效。
4.专利保护限制
对企业而言,需在专利保护期(通常20年)内收回成本,而药物上市时往往仅剩10年左右的独家销售期。这是因为专利通常在药物研发早期(如临床前研究阶段)就已申请,而从专利申请到药物完成三期临床试验、获得监管部门批准上市,平均需要10年左右。在这短短十余年的独家期内,企业不仅要覆盖数十亿甚至上百亿美元的研发投入,还要承担药物上市后监测(如不良反应追踪)、生产工艺优化等持续成本。为应对专利到期后的市场竞争,企业往往需要在专利期内快速提升销量,这也间接推高了生物药的初期定价。
5.市场规模有限
全球已知的罕见病已有至少7000种,其中多数疾病的患者人数仅为百万分之一甚至千万分之一。许多蛋白制剂针对罕见病而研发,但患者群体少,且患者分布分散,药物的流通和配送成本也随之上升,因此难以通过“薄利多销”降低价格。这种“小众需求”直接导致生产规模难以扩大,只能“小批量、多批次”进行,而每批次生产的启动成本(如生物反应器清洁、耗材更换、质控流程)是固定的,分摊到每支药物上的成本自然居高不下。
未来可期,让“天价药”走下神坛
医用蛋白制剂的“天价”困局,本质是一场与蛋白质“娇弱天性”的持久战。随着生物技术与多学科的深度融合,医用蛋白制剂正从“小众高价”向“大众可及”迈进,具体突破路径已初现端倪:
在生产端,新型细胞工程技术正打破传统培养的效率瓶颈,如2025年发布的使用微载体和生物反应器进行封闭且可扩展的3D培养工艺,在3升生物反应器的优化条件下,可实现间充质基质细胞的高倍扩增,细胞存活率高,回收效果好。
纯化环节的创新同样值得期待,一些如结晶法等低成本纯化手段正在被应用。研究者们选择带电聚合物、聚糖、生物模板等物质作为成核剂(一种能够促进结晶的物质类别),利用其与蛋白质分子的表面发生直接或间接的化学相互作用,可以得到稳定性和生物利用度更高的蛋白质药物晶体。
而微球缓释技术,可以降低给药频率,既可以长效控制,也可以降低冷链运输的频次与成本。最近,一种气体剪切微流控策略制造的微球,该微球含有三个负载胰岛素的腔室,腔室的释放数量可以随血糖浓度而调整,可以实现对血糖水平35小时的精确控制,并且封装效率、稳定性和生物相容性均较好。
科技创新的终极目标,是让每一项进步都能惠及普通人。或许在不久的将来,这些曾让人望而却步的“蛋白制剂”会像抗生素一样,成为触手可及的“救命常规药”,而这背后,是无数科研人员对“精准治疗”与“普惠医疗”的双重追求。

来源: 中国科普博览
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 中国科普博览
中国科普博览 
