近日,Science Bulletin发表了南京大学张辰宇教授团队题为“RNA immunity: an ancient defense mechanism preserved in mammalian cells”的综述文章。该文系统提出了“RNA免疫(RNA immunity)”的全新概念,并指出哺乳动物体内保留着一套以小RNA为核心、以碱基互补配对为识别机制的抗病毒系统。这种机制不同于传统依赖蛋白质的免疫体系,代表了针对病毒类疾病可能存在的“隐匿防线”。
传统观点认为,构成人体免疫系统的基本单元是免疫细胞和免疫蛋白。无论是快速响应的天然免疫,还是具有记忆功能的获得性免疫,均以蛋白质为主要效应分子。RNA曾被视为只在细胞内发挥功能,自2008年后才被发现能够在细胞外完整、稳定存在,能够被细胞主动分泌,在组织、器官间传递并发挥调控功能。
该综述通过总结近年来多项针对病毒感染类疾病中细胞外RNA功能的研究,指出以miRNA为代表的RNA分子,可以通过碱基互补配对的方式精准识别病毒基因,其效率和特异性在某些情境下甚至优于传统的免疫应答。在病毒侵入时,人体内源小RNA、外源植物小RNA及病毒自身编码小RNA均会在感染过程中发挥不同功能,共同构成了RNA免疫调控网络(图1)。研究团队据此提出,RNA免疫可能是人体免疫体系中尚未被认知的一类新型免疫方式,与以蛋白质分子为主要效应分子的免疫系统互为补充。
文章亮点如下:
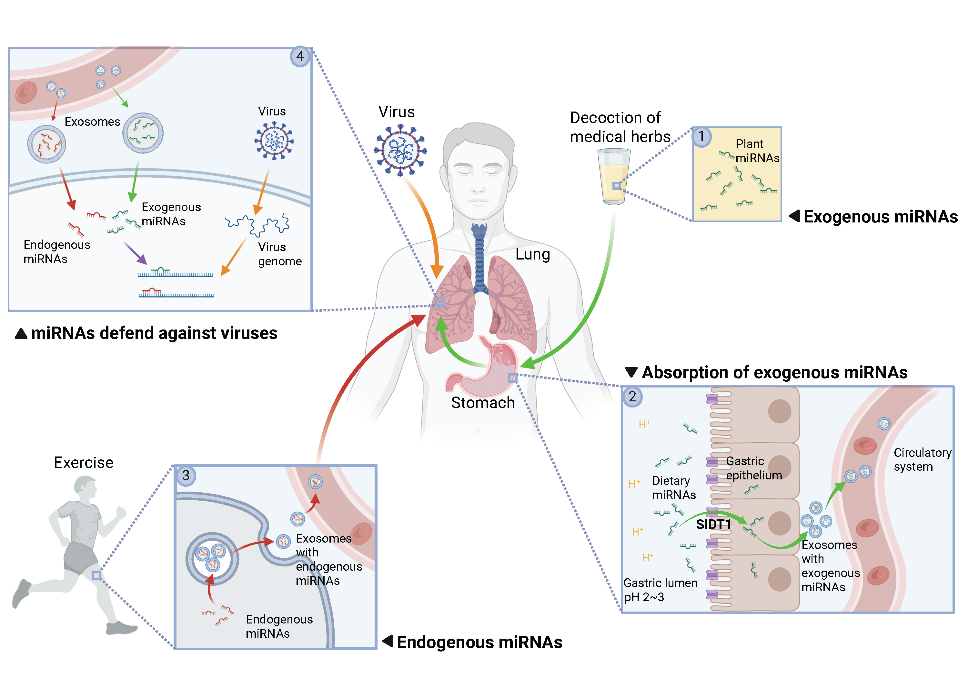
图1. 不同来源的细胞外RNA在人体内共同构成RNA免疫分子网络
1 RNA免疫基于序列互补对病毒精准打击,具备高度特异性与抗突变能力
传统免疫识别机制主要依赖蛋白质三维结构的“构象互补”,如抗体与抗原的结合。然而这类结构识别在面对病毒频繁发生的点突变时,常常容易失效。而RNA免疫则采用碱基之间的互补配对实现靶向识别和沉默病毒。这种方式不仅更精确,并且往往能够在一个病毒基因上发现多个结合位点,即使病毒发生局部突变,也难以完全逃逸。这一机制赋予RNA免疫出色的抗变异能力和多靶点协同效应,在新发病毒和高变异病毒感染中具有重要防御潜力。过去,学界普遍认为这种机制只存在于植物、昆虫等“低等”生物中,而哺乳动物早已在进化中舍弃了这种系统。但近年来的发现表明,哺乳动物并未完全丧失RNA免疫功能,而是将其以更加隐蔽和动态调控的方式保留并整合至其免疫体系中,这可能是哺乳动物在与病毒共进化过程中发展出的一种“狡猾”的适应方式。
2 不依赖特化免疫系统,构成“去中心化”免疫网络
如果说天然免疫和获得性免疫是军队中的“特种部队”,只由特定的免疫细胞执行任务,那么RNA免疫就是一场“全民战争”:几乎所有类型的体细胞均具备合成、释放功能性小RNA分子的能力。这些小RNA不仅可在细胞内部起作用,还可通过外泌体等方式在细胞间转移,参与多组织协同应答。这就像比特币区块链的原理——没有中央指挥,每个节点都是行动单元,因此更具弹性、更难被病毒完全突破。相比依赖复杂调动机制的蛋白免疫反应,RNA免疫能更早、更快对高传染性病毒进行早期响应和抑制。
3 RNA免疫效应分子不仅能自身生产,还能靠“进口”
研究发现,由人体自身生产的抗病毒RNA分子在年轻人血液中更充足,但会受到衰老、基础疾病等不良因素的影响而下降,也能够随着运动而提高,这说明RNA免疫能力也会随着人体状态的不同而动态变化。更令人惊讶的是,RNA免疫的效应分子并不局限于人体自身产生的分子,某些植物中的小RNA(比如中草药金银花中的MIR2911)在被人体摄入后,可以经胃肠吸收进入血液,通过细胞间的外泌体传输系统送达全身组织,并直接干扰病毒的复制。这些外源吸收的“RNA弹药”,能够有效补充体内的RNA免疫效应分子,增强人体对病毒的作战能力。研究甚至表明,某些个体的遗传差异会影响这类植物RNA的吸收效率,提示我们未来可以基于个体差异,开发出精准化的饮食干预手段或新型抗病毒药物。
该研究所提出的“RNA免疫”概念,为哺乳动物抗病毒防御机制提供了全新的研究方向。RNA免疫通过碱基互补识别实现精确、多位点的干扰,其机制兼具分布广泛性、反应快速性和来源多样性,不仅为传统免疫系统提供有力补充,也可能解释某些免疫现象中蛋白机制难以覆盖的空白。通过进一步研究这套RNA免疫系统的工作原理和调控机制,将有望为理解人类与病毒的相互适应关系提供新的视角。该方向的新发现与RNA药物和小RNA递送技术的结合,也有望为新型抗病毒药物设计、RNA疫苗开发、个性化治疗等领域提供重要理论依据和实践路径。
来源: 《中国科学》杂志社


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 《中国科学》杂志社
《中国科学》杂志社 
