郭莉娟1,2 ,谢建平1
1.西南大学生命科学学院现代生物医药研究所;2.成都医学院检验医学院
引言:免疫治疗的“双刃剑”效应
近期,美国卫生与公共服务部(HHS)对美国疾病控制与预防中心(CDC)疫苗咨询委员会(ACIP)的全面改组引发轩然大波,HHS新任部长小罗伯特·肯尼迪以"利益冲突"为由撤换全部专家成员,并公开质疑疫苗安全性[1]。这一争议事件再次将"免疫治疗"推向风口浪尖。
近年来,免疫治疗(如PD-1/PD-L1、CTLA-4抑制剂)在癌症治疗中取得了突破性进展,帮助许多患者重获新生[2]。然而,部分患者在接受治疗后却出现了不良反应。如1976年美国因担心猪流感(H1N1)大流行,紧急推广全民疫苗接种,最终疫苗导致约450人出现格林-巴利综合征(一种罕见的神经系统疾病),甚至发生接种后死亡病例[3]。同样,COVID-19mRNA疫苗亦报告过心肌炎病例[4-5]。这种受种者正处于某种疾病的潜伏期,或存在尚未发现的基础疾病,接种后出现了“免疫过度激活”巧合发病的现象,被称为免疫偶合症(immune-related adverse events,irAEs)。简单来说,就是疫苗或免疫治疗在激活免疫系统对抗疾病时,有时会"误伤"健康细胞,引发副作用。

图1 irAEs发生插画
为什么同样的药物,有些人安然无恙,有些人却出现严重副作用?科学家发现,答案可能藏在我们的基因里。今天,我们就来探索免疫偶合症的免疫遗传基础,看看哪些基因在“暗中操控”这一过程。
一、免疫系统如何“失控”?
要理解免疫偶合症,首先要明白免疫系统是如何工作的。正常情况下,免疫系统能精准识别“敌人”(如病毒、癌细胞)和“自己”(正常组织),避免误伤,而识别“自己”和“敌人”过程中的关键要素是诱发免疫应答的抗原、小分子和肽。其中免疫检查点(如PD-1、CTLA-4)是免疫细胞产生的调节自身免疫功能的蛋白小分子,可以像“门禁”一样抑制过度免疫反应,免疫系统就不会过度活化,防止自身免疫病。然而,免疫治疗药物(如PD-1抑制剂)会解除这些“门禁”,让免疫系统全力攻击“敌人”。但有时,这种“解禁”也会让免疫系统失去控制,错误攻击正常组织,导致免疫偶合症。
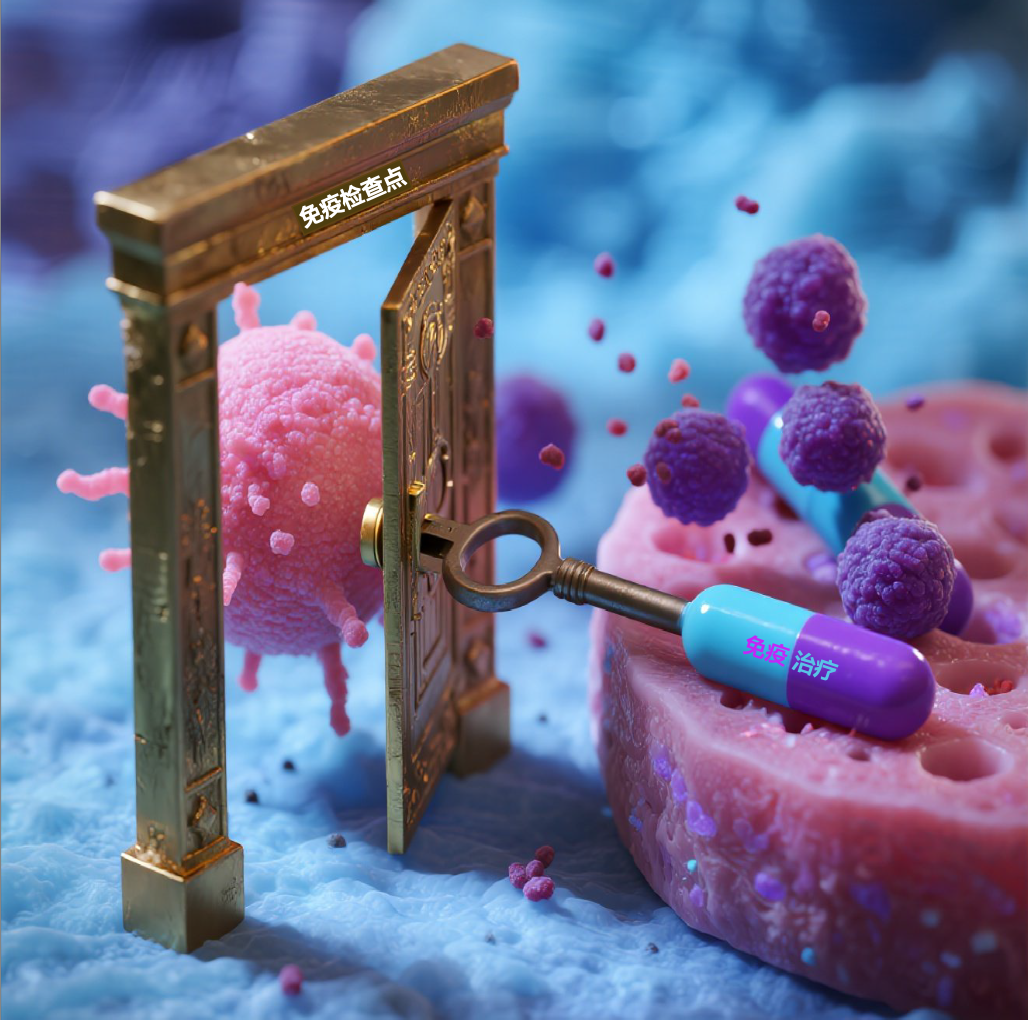
图2 免疫检查点作用插画
问题:为什么有些人更容易出现这种“误伤”自己?答案可能藏在他们的基因里。
二、基因如何影响免疫偶合症的风险?
科学家通过大量研究发现,某些人的基因使他们更容易在免疫治疗后出现副作用。这些基因主要涉及:
1. 免疫调控因子:谁在控制“门禁”和“钥匙”?
HLA基因:HLA(human leukocyte antigen,HLA,人类白细胞抗原)基因是免疫系统中最重要的遗传因素之一,负责帮助免疫细胞识别“自己”和“异己”。不同人的HLA基因型存在差异,这影响了他们对免疫治疗的敏感性。HLA分子可分成三大类--HLA-I、II、III类基因,每一类基因均含有多个座位。科学家发现,在免疫治疗中,当一个人的HLA-Ⅰ分子杂合性越高,也就是的HLA-I类基因越多样化,免疫治疗效越好,如果是肿瘤突变,那效果会更好[6]。
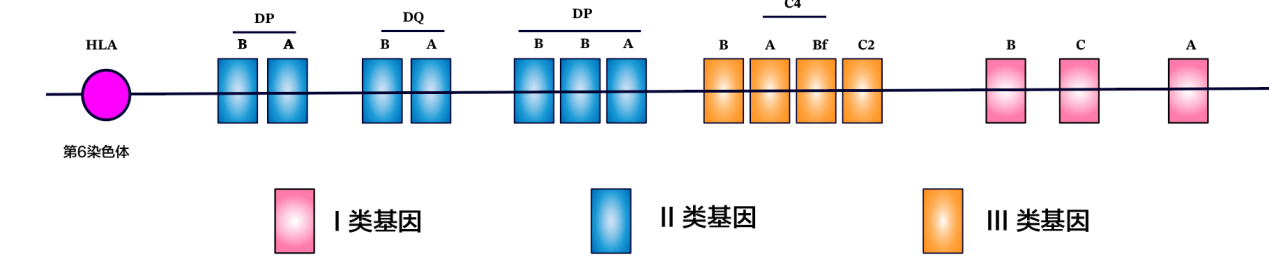
图3HLA基因座位结构示意图
除了HLA,还有许多基因参与免疫调控,它们的变异可能增加irAEs风险:
CTLA-4基因:CTLA-4是重要的免疫抑制分子,某些变异可能导致免疫调控失衡,使T细胞更容易攻击自身组织[2,7]。
PTPN22基因:该基因变异与类风湿性关节炎、系统红斑狼疮等自身免疫病相关,也可能增加irAEs风险[8,9]。
IL-17、NF-κB:这些细胞因子基因的变异可能导致更强的炎症反应,使irAEs更严重[10]。
2. 遗传因素
性别差异:女性比男性更容易发生某些irAEs(如内分泌系统疾病、肝脏系统疾病及格雷夫斯等)有更高的发生概率,可能与性染色体基因(如X染色体上的FOXP3)有关[11,12],但是男性irAEs出现肾毒性的几率高于女性,且irAEs的预后较女性更差[13]。
种族差异:转移性肾细胞癌中非裔美国人患者的中位无进展生存期(PFS)显著短于白种人患者,且中非裔美国患者中出现irAEs的比例更高[14]。但是一项研究证明实体瘤的irAEs研究中,美国白种人的比例显著高于非裔美国人[15]。
年龄因素:研究发现,irAEs的发生率在老年患者中显著更高[15]。
3.环境与表观遗传的影响
除了先天基因,后天因素也在irAEs中扮演重要角色:
1). 肠道菌群:免疫系统的“隐形教练”
肠道微生物能训练免疫系统,影响其攻击性。某些菌群(如Bacteroides减少)可能导致Th17/Treg失衡,增加irAEs风险。如治疗黑色素瘤患者中具有良好肠道菌群的,其全身性和抗肿瘤免疫得到增强[16]。
2). 表观遗传:基因的“开关”被谁操控?
即使基因序列不变,DNA甲基化或组蛋白修饰也能影响基因表达。例如:FOXP3基因(调控Treg功能)的表观沉默可能导致免疫抑制减弱,增加irAEs风险。病毒感染(如EBV)可能通过表观修饰激活自身免疫相关基因。
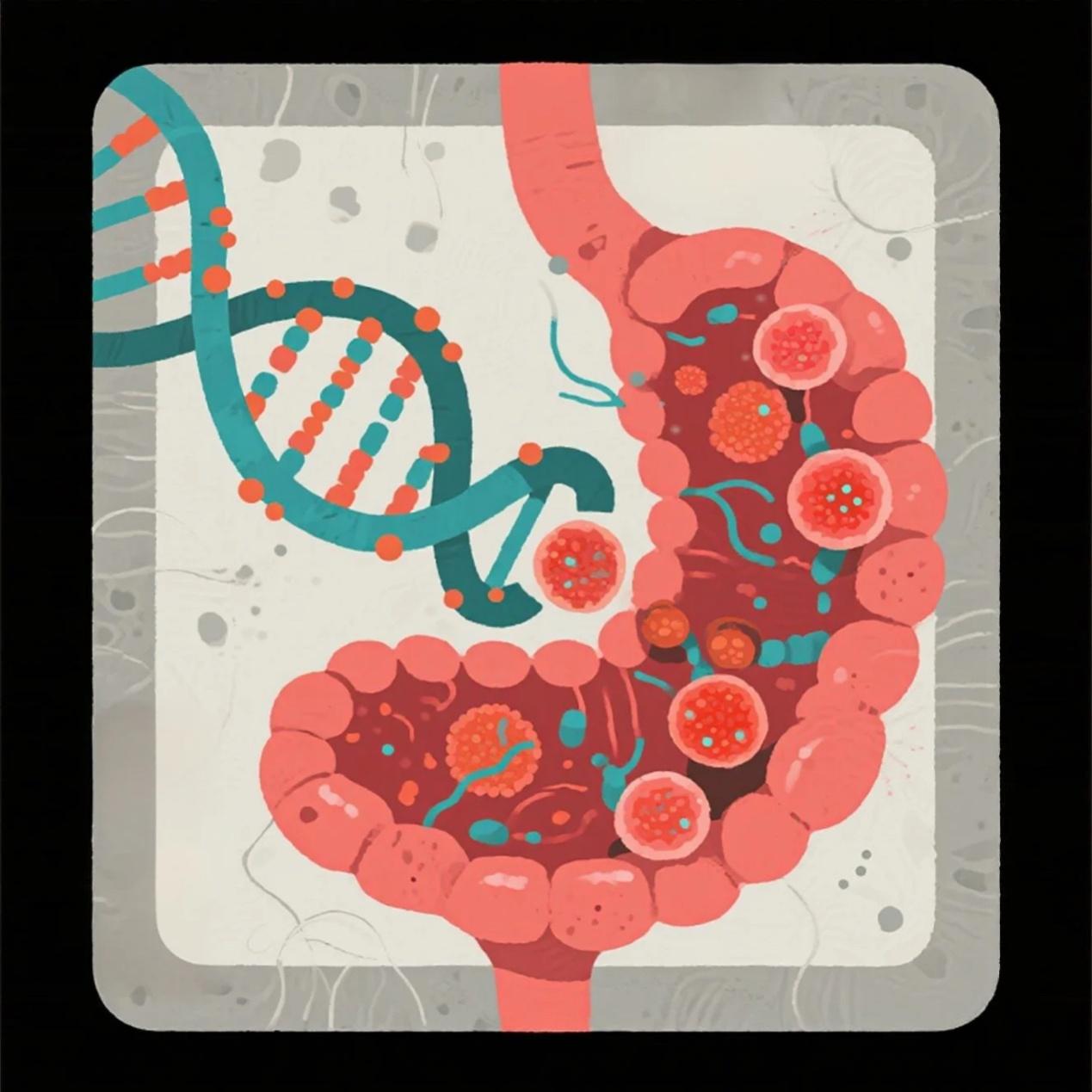
图4肠道微生物和表观遗传影响irAEs插画
四、如何利用遗传学知识优化治疗?
了解免疫偶合症的遗传基础,可以:
预测高风险患者:如通过HLA分型或GWAS(全基因组关联分析)筛选易感人群,提前监测。
个体化治疗:对高风险患者调整免疫治疗方案(如改用低剂量或联合治疗)。
精准干预:针对免疫检查点(如IL-6、JAK-STAT)使用靶向药物控制irAEs。
免疫治疗是一把“双刃剑”,我们更好地驾驭它,就要弄清楚它的遗传学基础,让更多患受益的同时,减少不必要的伤害。
参考资料:
RFK Jr.'s HHS ousts entire roster of CDC vaccine expert committee;Fierce Pharma
Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell. 2017;168(4):707-723. doi:10.1016/j.cell.2017.01.017
Schonberger LB, Hurwitz ES, Katona P, Holman RC, Bregman DJ. Guillain-Barré syndrome: its epidemiology and associations with influenza vaccination. Ann Neurol. 1981;9 Suppl:31-38. doi:10.1002/ana.410090707
Mevorach D, Anis E, Cedar N, et al. Myocarditis after BNT162b2 mRNA Vaccine against Covid-19 in Israel. N Engl J Med. 2021;385(23):2140-2149. doi:10.1056/NEJMoa2109730
Oster ME, Shay DK, Su JR, et al. Myocarditis Cases Reported After mRNA-Based COVID-19 Vaccination in the US From December 2020 to August 2021. JAMA. 2022;327(4):331-340. doi:10.1001/jama.2021.24110
Chowell D, Morris LGT, Grigg CM, et al. Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy. Science. 2018;359(6375):582-587. doi:10.1126/science.aao4572
Khan S, Khan SA, Luo X, et al. Immune dysregulation in cancer patients developing immune-related adverse events. Br J Cancer. 2019;120(1):63-68. doi:10.1038/s41416-018-0155-1
Ishigaki K, Lagattuta KA, Luo Y, James EA, Buckner JH, Raychaudhuri S. HLA autoimmune risk alleles restrict the hypervariable region of T cell receptors. Nat Genet. 2022;54(4):393-402. doi:10.1038/s41588-022-01032-z
Kyogoku C, Langefeld CD, Ortmann WA, et al. Genetic association of the R620W polymorphism of protein tyrosine phosphatase PTPN22 with human SLE. Am J Hum Genet. 2004;75(3):504-507. doi:10.1086/423790
Sun B, Xun Z, Zhou Z, et al. Single-cell transcriptomic analysis deciphers the inflammatory microenvironment characterized by CXCL9+ fibroblasts and ACKR1+ endothelial cells in immune-related myocarditis. J Transl Med. 2025;23(1):555. Published 2025 May 16. doi:10.1186/s12967-025-06551-x
: Rosalba Miceli, Hanna Eriksson, Alex J. Eustaceetal., Sex differences in burden of adverse events in patients receiving immunotherapy.Journal of Clinical Oncology.2023,42,16,suppl:2646. https://doi.org/10.1200/JCO.2023.41.16_suppl.2646
Tan G, Zheng G, Li J, et al. Association of genetic variations in FoxP3 gene with Graves' disease in a Southwest Chinese Han population. ImmunInflamm Dis. 2023;11(10):e1046. doi:10.1002/iid3.1046
Chen C, Zhang C, Jin Z, Wu B, Xu T. Sex differences in immune-related adverse events with immune checkpoint inhibitors: data mining of the FDA adverse event reporting system. Int J Clin Pharm. 2022;44(3):689-697. doi:10.1007/s11096-022-01395-7
Olsen TA, Martini DJ, Goyal S, et al. Racial Differences in Clinical Outcomes for Metastatic Renal Cell Carcinoma Patients Treated With Immune-Checkpoint Blockade. Front Oncol. 2021;11:701345. doi:10.3389/fonc.2021.701345
Peravali M, Gomes-Lima C, Tefera E, et al. Racial disparities in immune-related adverse events of immune checkpoint inhibitors and association with survival based on clinical and biochemical responses. World J Clin Oncol. 2021;12(2):103-114. doi:10.5306/wjco.v12.i2.103
Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science. 2018;359(6371):97-103. doi:10.1126/science.aan4236
来源: 邹老师的科普花园


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 邹老师的科普花园
邹老师的科普花园 
