近日,大理大学药学院-南京大学医学院研究人员在著名学术期刊Science Advances上发表了病毒感染导致肌肉酸痛的分子机制一文。南京大学医学院博士生由巧为第一作者,大理大学药学院何苗,大理大学药学院/南京大学医学院吴稚伟为共同通讯作者。文章发表于You et al., Sci. Adv. 11, eadt9837(2025) 16 May 2025。
肌肉酸痛是病毒性传染病发病时最常见的症状之一。肠道病毒、流感病毒、甲病毒、黄病毒、布尼亚病毒和冠状病毒等多种病毒感染都会使患者出现肌肉酸痛、疲劳的症状,影响患者的生活质量。肌肉酸痛是病毒感染患者寻求医疗帮助的常见原因,疼痛的缓解也是临床评估抗病毒药物疗效的关键指标。因此,考虑到抗病毒药物的开发效益,研究病毒性肌肉酸痛的基本科学机制,尤其是不同病毒的共同机制至关重要。
近年来,以“脑-肌肉”信号轴为代表的人体内不同器官之间的交流,为病毒性肌肉酸痛的研究提供全新的思路。以炎症因子为代表的免疫因子与代谢产物在疾病中的交叉作用为肌肉酸痛的发生、发展提供全新的角度。
该研究以肠道病毒A71型(Enterovirus A71,EV-A71)为模式病毒,成功构建病毒感染诱发肌肉酸痛的小鼠模型。结果显示,EV-A71感染C57BL/6J小鼠引发肌肉酸痛;EV-A71感染AG6小鼠(I型、Ⅱ型干扰素受体缺陷的C57BL/6J小鼠)引发肌肉酸痛、肌肉力量减弱、运动协调能力减弱;EV-A71重度感染AG6小鼠诱发肢体麻痹。
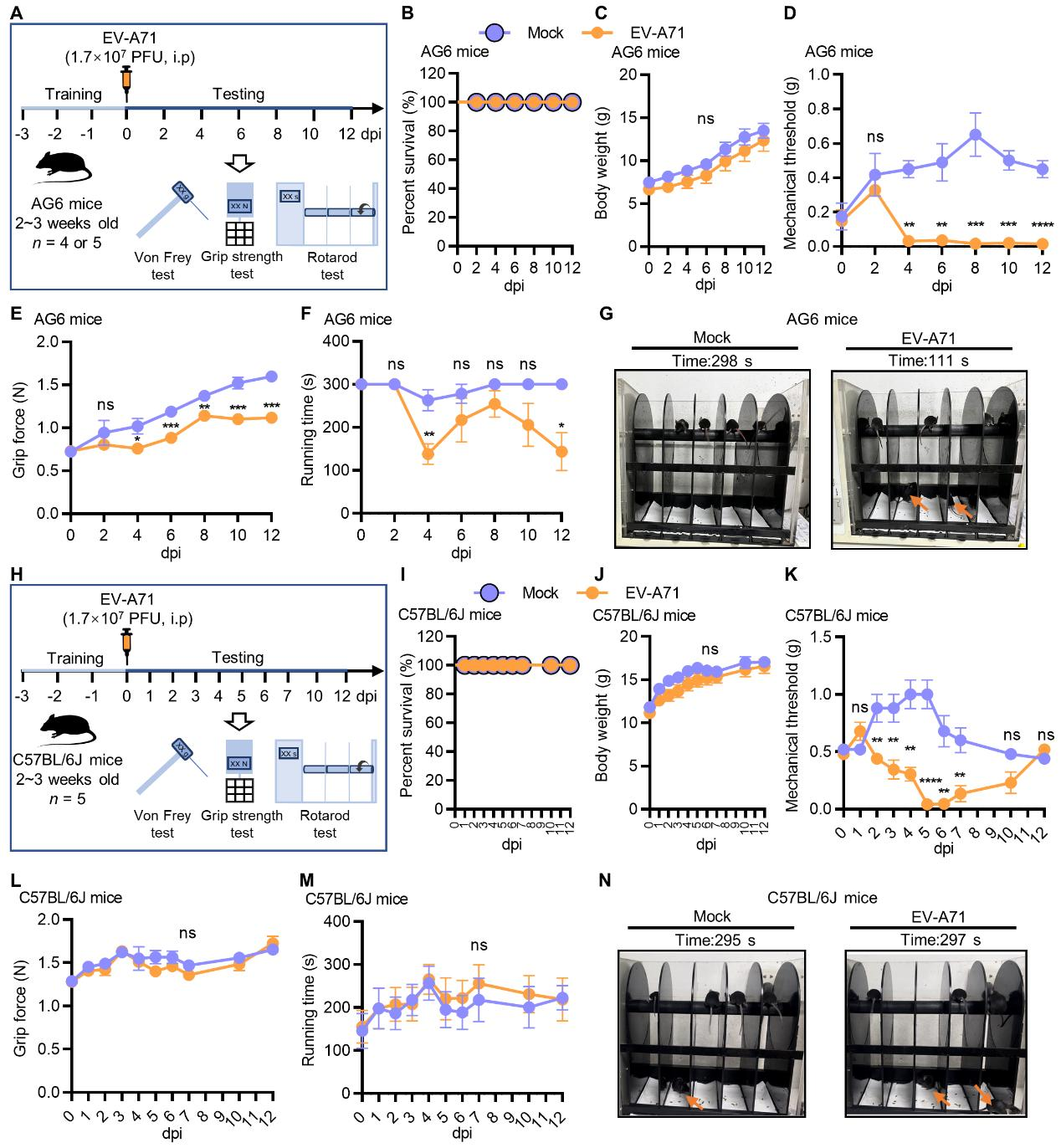
图1 EV-A71感染诱发小鼠肌肉酸痛
对来自多种病毒感染的鼠类脑部的转录组数据进行分析发现,脂质运载蛋白2(Lipocalin 2)可能在病毒感染诱发的肌肉酸痛中发挥重要作用。实验验证发现,脑中星形胶质细胞来源的LCN2介导了EV-A71感染诱发的肌肉酸痛,提示“脑-肌肉”轴发挥了重要作用。具体表现为,同龄的Lcn 2-/-小鼠具有比WT(C57BL/6J)小鼠更高的机械痛觉阈值和更强的爪握力;有趣的是,重组小鼠LCN2(rmLCN2)的注射降低了WT小鼠和Lcn 2-/-小鼠的痛阈,同时rmLCN2的注射减弱了Lcn 2-/-小鼠的握力,注射rmLCN2的WT小鼠的握力没有受到明显影响。尽管在实验过程中观察到个别Lcn 2-/-小鼠和WT小鼠在注射rmLCN2后运动能力受到了影响,但这种影响没有差异显著性。在EV-A71感染的过程中,尽管Lcn 2-/-小鼠体重比WT小鼠轻,Lcn 2-/-小鼠仍然具有更高的痛阈和更强的爪握力。给予Lcn 2-/-小鼠rmLCN2会显著降低痛阈并减弱爪握力。与感染了EV-A71的WT小鼠相比,Lcn 2-/-小鼠的奔跑时间更长、运动协调能力更好;而注射rmLCN2则显著减弱了Lcn 2-/-小鼠的运动能力。
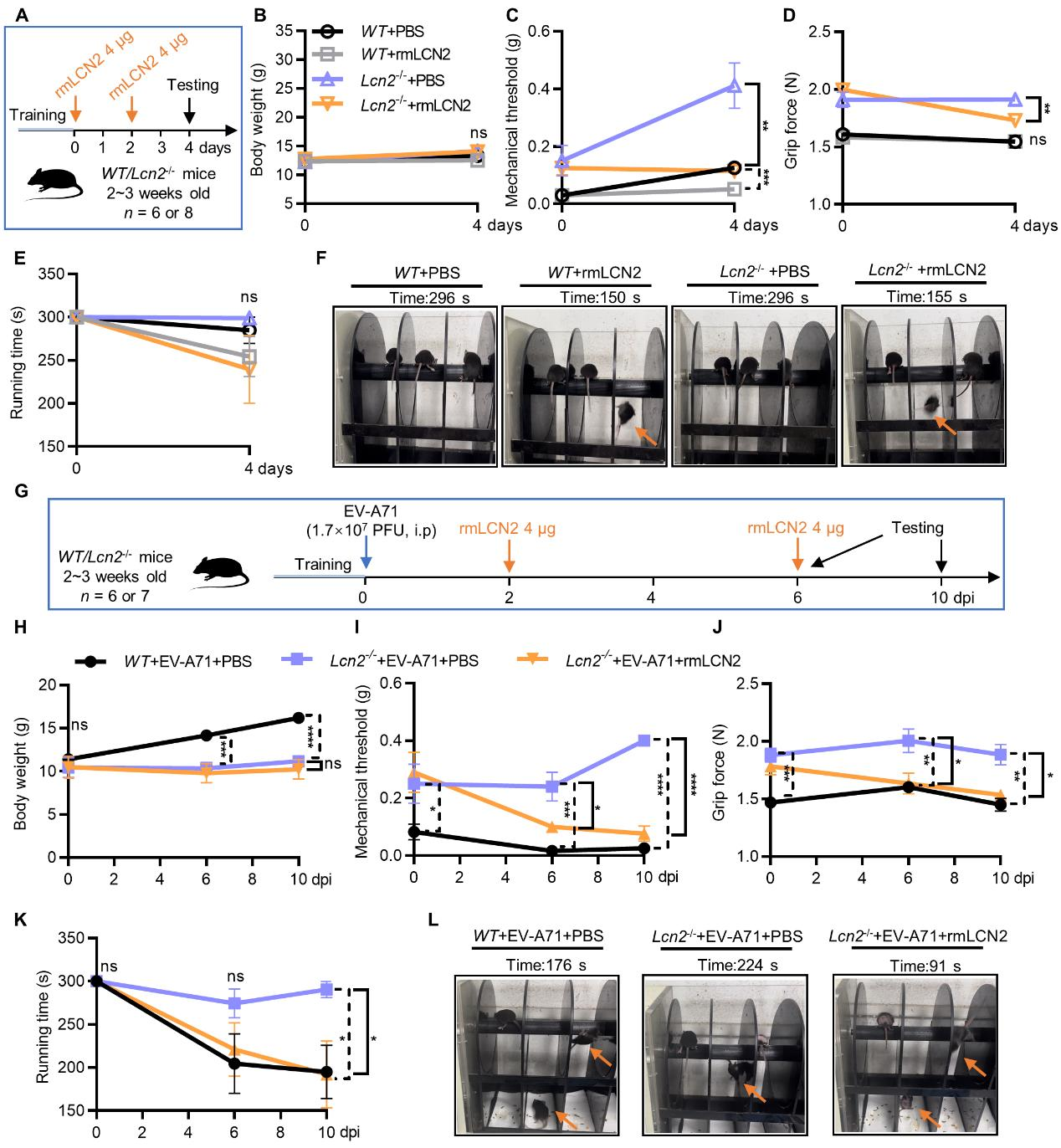
图2 LCN2介导EV-A71感染引发的肌肉酸痛
进一步的分子机制探究发现,LCN2通过上调丙酮酸脱氢酶激酶1(Pyruvate dehydrogenase kinase 1, PDK1)的mRNA的表达,以及降低丙酮酸脱氢酶(Pyruvate dehydrogenase, PDH)活性介导细胞内乳酸的积累和细胞外酸碱度(Pondus hydrogenii, PH)值的降低。前人的研究显示葡萄糖、蛋白质等代谢反应产生的酸性物质刺激肌肉中的分子感受器时,引发Na+、Ca2+的内流,进而诱发动作电位的产生;肌肉内注射代谢物组合包括H+,乳酸和ATP能够激活感觉神经元,引发人体强烈的疲劳感和疼痛感。有趣的是,该研究中揭示的小鼠肌肉组织中乳酸的积累在许多其他病毒感染中也会发生。这提示,由感染引发的肌肉组织中乳酸的积累正是病毒性肌肉酸痛的重要诱因。
由于EV-A71是嗜神经病毒,具备跨越血脑屏障或逆向神经运输的能力,晚期重度感染时可直接感染脑中的星形胶质细胞,诱导LCN2的分泌;而很多其他的病毒不具备感染中枢神经系统的能力或在感染早期不感染中枢神经系统,但患者仍然表现出肌肉酸痛的症状,这就意味着可能有其它警报因子介导脑来源的LCN2的分泌。该研究结合前期研究(You et al., Virus Research, 2023)揭示体内广泛表达的损伤相关分子模式高迁移率组蛋白B1(High mobility group B1, HMGB1)在EV-A71感染肠道后大量释放到外周循环系统,进而诱导脑部星形胶质细胞中LCN2的分泌。总之,HMGB1/LCN2/PDK1/乳酸轴介导EV-A71感染引发的肌肉酸痛,施用HMGB1中和抗体能够缩短EV-A71感染后肌肉酸痛的时间。
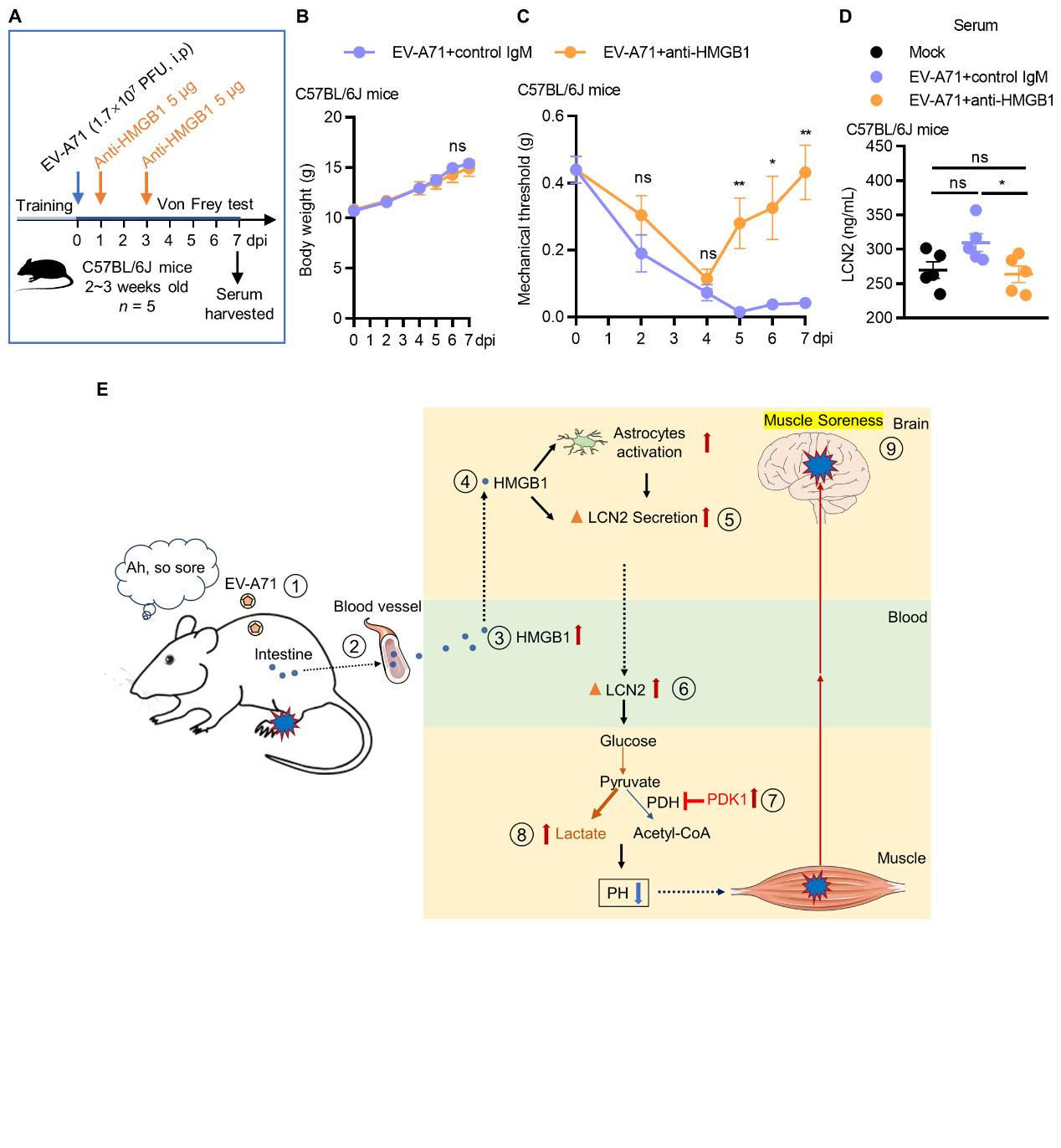
图3 HMGB1中和抗体施用效果及文章模式图
作者: 刘润
来源: 大理大学生物科学馆


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

