摘要
人类在演化中褪去体毛,成为“裸猿”,这一过程不仅改变了外形,更重塑了皮肤微生态。本文从演化医学视角,揭示人类皮肤微生物群的适应与冲突:原本共生的细菌如何因环境剧变成为“双刃剑”,既参与皮肤屏障构建,又引发痤疮、衰老等问题。通过案例与前沿研究,展现微生物与宿主的博弈,并展望精准调控皮肤菌群的未来方向。

引言
120万年前,人类的祖先褪去浓密体毛,成为“裸猿”。这一演化选择让人类获得了超凡的散热能力,但也让皮肤直接暴露在复杂环境中。失去毛发的“防护服”后,皮肤表面形成了独特的微生态——数百万微生物在此定居,既是盟友,也是隐患。从痤疮到衰老,这些“隐形居民”如何影响人类健康?演化医学为我们揭开了这场持续百万年的相爱相杀,爱恨情仇。
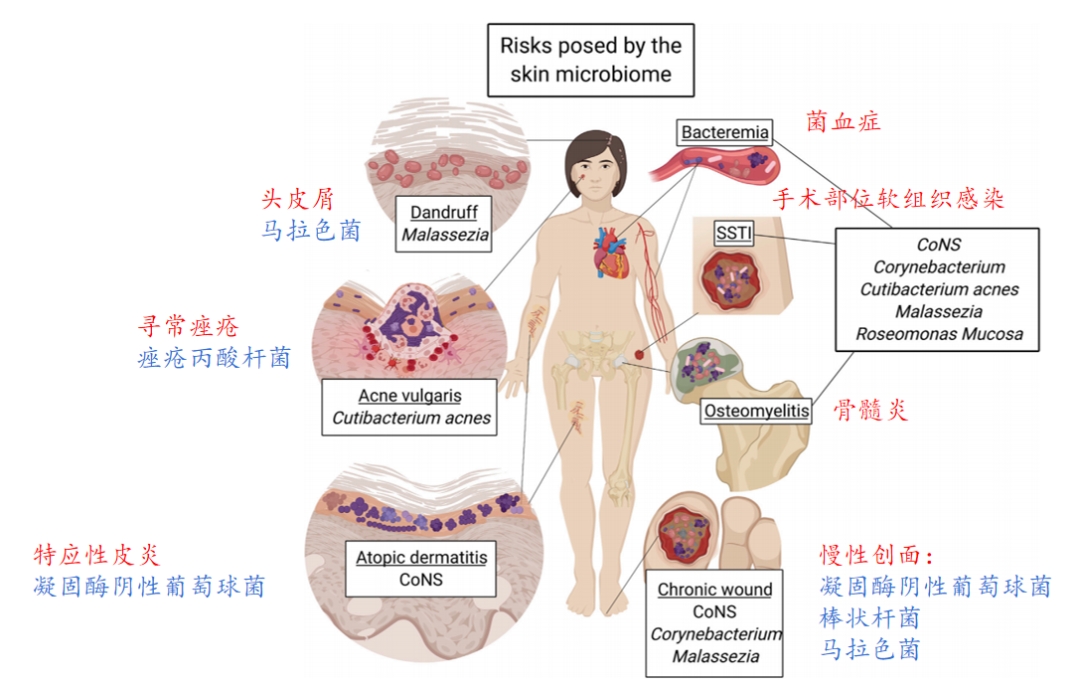
正文
一、毛发褪去:皮肤微生态的“大重构”
人类体毛的退化始于对耐力的追求。早期人类在非洲草原上长途追逐猎物时,浓密毛发阻碍汗液蒸发,导致体温飙升。基因突变(如KRTHAP1假基因失活)让体毛逐渐变为细小的汗毛,汗腺密度增加,成为“裸猿”的标志。然而,这一变化也颠覆了皮肤环境:原本分散在毛发中的微生物被迫聚集在毛孔和褶皱处,形成新的“微生物部落”。
案例:虱子的演化密码
人体虱子的分化记录了毛发退化的时间轴。当人类全身毛发连成一片时,虱子只有一种;随着毛发退去,头虱、阴虱和体虱(依附衣物)相继分化。分子钟分析显示,人类约120万年前开始褪毛,5万年前因穿衣出现体虱——这一时间线与皮肤微生物群的重构高度吻合。

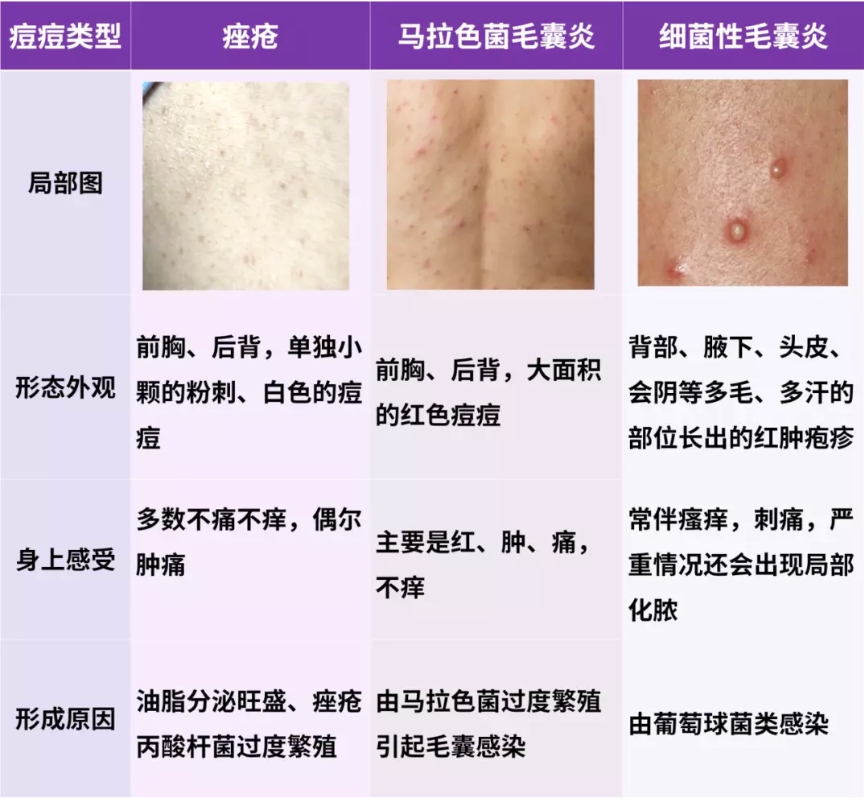
二、微生物的“双刃剑”:从共生到冲突
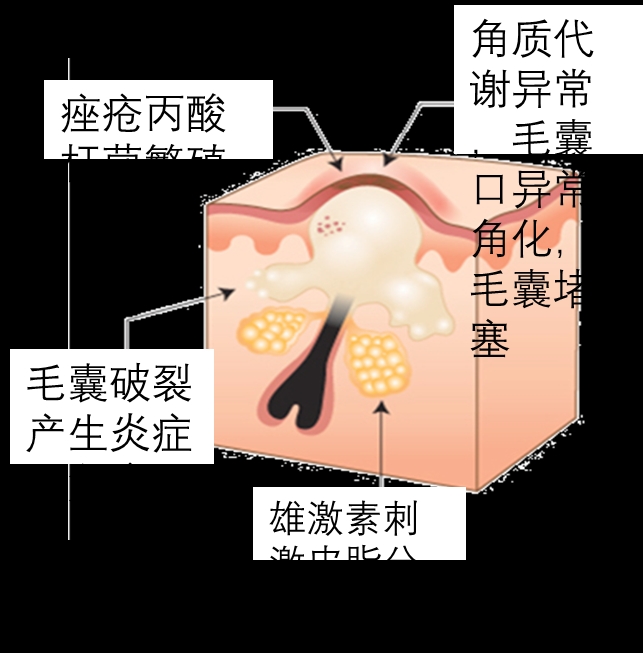
1. 痤疮丙酸杆菌:油脂与炎症的博弈
作为皮肤常驻菌,痤疮丙酸杆菌(Cutibacterium acnes)原本负责分解皮脂、抑制有害菌。但毛囊堵塞时,它大量繁殖并分解甘油三酯为游离脂肪酸,刺激免疫系统释放炎症因子(如TNF-α),最终引发红肿痘痘。有趣的是,同一菌种的不同菌株可能“亦敌亦友”:某些菌株促进炎症,另一些则参与皮肤屏障修复。
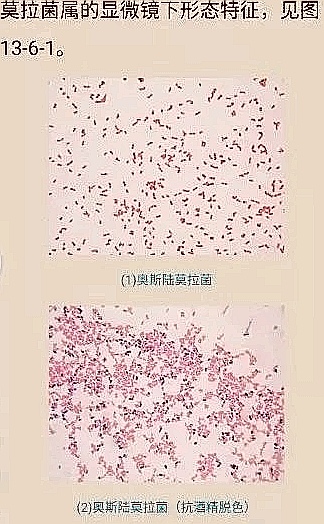
2. 奥斯陆莫拉菌:衰老的加速器?
2024年一项针对822份皮肤样本的研究发现,奥斯陆莫拉菌(Moraxella osloensis)会干扰胶原代谢,加速成纤维细胞衰老。该菌在老年群体中丰度显著升高,而痤疮丙酸杆菌则随年龄减少,揭示了微生物群与皮肤老化的动态关联。
三、演化失配:现代生活加剧微生物失衡
原始人类的皮肤微生物与宿主长期协同演化,但现代生活方式打破了平衡:
- 饮食:高糖乳制品刺激雄激素,加剧皮脂分泌,为痤疮丙酸杆菌提供“养料”;
- 化妆品:油性成分堵塞毛孔,创造厌氧环境,促进致病菌增殖;
- 过度清洁:破坏菌群多样性,削弱皮肤自愈能力。
案例:城市vs部落的微生物差异
宏基因组研究发现,城市人群皮肤菌群中耐药基因丰度更高,可能与抗生素滥用有关;而某些原始部落人群保留更丰富的共生菌,如具有抗炎功能的表皮葡萄球菌。
展望:从“杀菌”到“养菌”
未来皮肤健康管理或将聚焦微生物精准调控:
1. 噬菌体疗法:针对致病菌(如促炎型痤疮丙酸杆菌)投放特异性病毒,避免广谱抗生素的“无差别打击”;
2. 微生物移植:移植健康供体的共生菌群,重建皮肤屏障;
3. 代谢干预:通过光动力疗法或局部益生元,调节皮脂腺基因表达,从源头减少菌群失衡风险。
总结
人类褪去体毛的演化选择,意外开启了皮肤与微生物的复杂共生史。痤疮、衰老等“现代病”背后,是微生物群与宿主适应速度的错配。理解这场持续百万年的“微生态战争”,将帮助我们从演化视角重新定义皮肤健康——不是消灭微生物,而是重建平衡。
参考文献
1. 百度知道日报. (2022). 大部分动物浑身是毛,为何人类只有阴毛、腋毛和头发?
2. 刘晓, 王久存等. (2024). 培养和非培养方法揭示特定细菌在皮肤老化中的作用[J].
3. 360doc. (2022). 114万年前发生了啥?人类只剩头发、腋毛、阴部等处毛发有啥用?
4. 39疾病百科. (2025). 为啥会长痤疮[网页].
5. Adv Sci. (2023). 人类皮肤细菌基因组综合目录揭示微生物组多样性[网页].
6. Cell Host & Microbe. (2022). 解剖学促进皮肤微生物群菌株共存[J].
7.莫利斯, D. (2021). 《裸猿》. 上海译文出版社.
来源: 自创


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 传染病DR.Chen
传染病DR.Chen 
