摘要
亨廷顿舞蹈症(Huntington’s Disease, HD)是一种致命的常染色体显性遗传神经退行性疾病,患者通常在中年发病并逐渐丧失运动、认知和精神功能。然而,这一“死亡之舞”的基因却未在演化中被淘汰。近年研究发现,携带HD基因的个体可能因某些生理或行为特征,在生育年龄前表现出更高的生殖成功率。本文从演化医学角度解析HD基因的存续之谜,结合案例探讨其可能的生殖优势机制,并展望未来研究的突破方向。
引言
1872年,美国医生乔治·亨廷顿首次描述了这种以“不自主舞蹈样动作”为特征的疾病。尽管HD基因突变会引发致命后果,但其在全球人群中仍以约1/10000的频率持续存在。为何自然选择未能淘汰这一基因?演化医学提出了一种反直觉的解释:HD基因可能在人类演化中赋予了携带者某种生殖优势。
正文
1. HD基因的“矛盾优势”
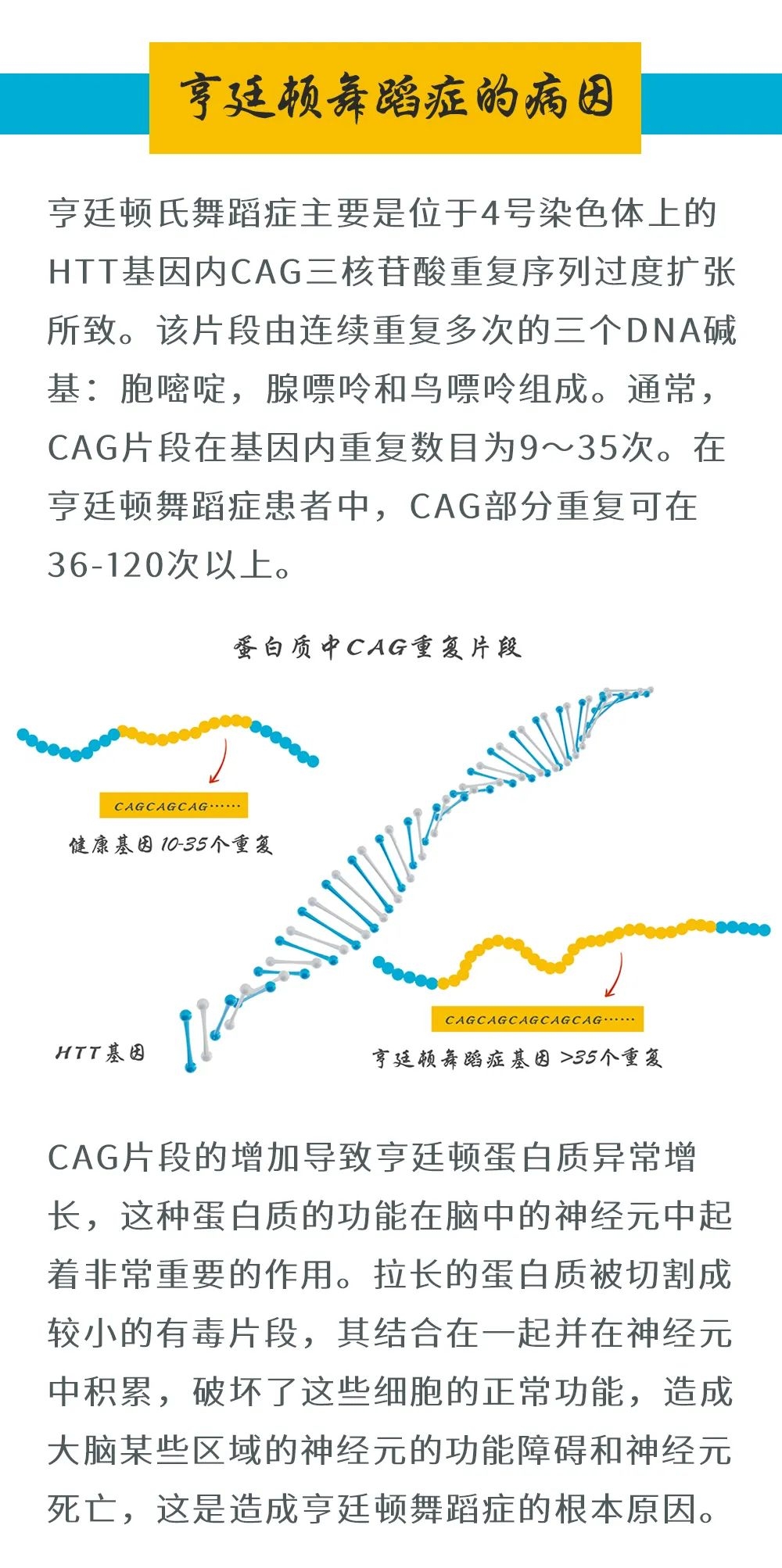
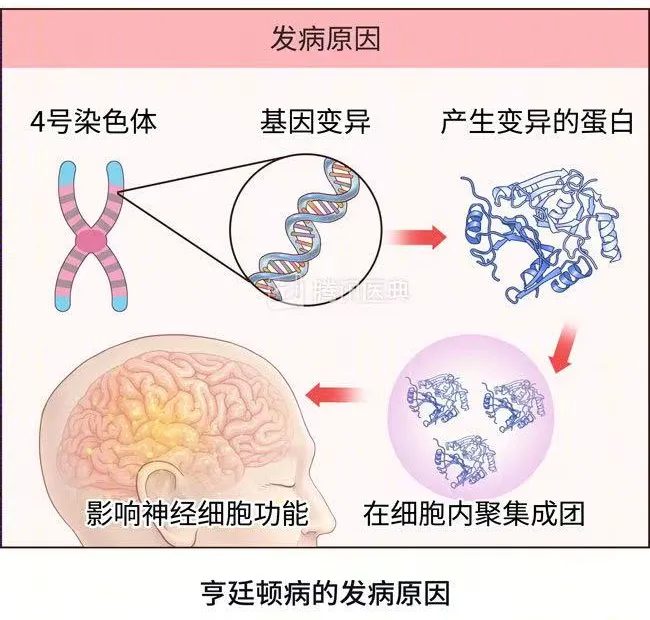
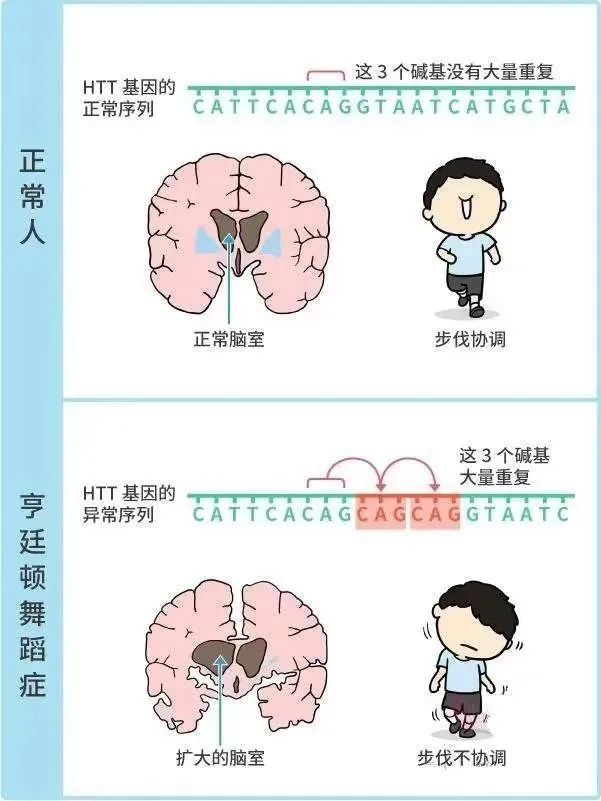
HD的致病机制明确——位于4号染色体的HTT基因中CAG三核苷酸重复扩增导致毒性蛋白聚集,最终引发神经元死亡。患者通常在40岁左右发病,病程持续15-20年。然而,HD基因携带者在生育高峰期(20-40岁)通常尚未发病,这为其基因传递提供了时间窗口。此外,研究提示以下潜在生殖优势:
(1)性欲亢进与生育行为
HD早期患者常出现精神症状,如性欲亢进、冲动行为等。例如,英国案例中,一名携带HD基因的父亲在发病前生育了5个子女,远超当时社会平均水平。类似现象在多个HD家系中均有记录,提示基因携带者可能因行为改变而增加生育机会。

(2)基因早现现象与生育窗口
HD的遗传存在“早现现象”,即后代发病年龄可能提前。然而,携带者在自身生育期内通常健康,甚至可能因未发病的“健康状态”增强吸引力或生育意愿。
(3)社会文化因素的推波助澜
在医疗不发达的时代,HD症状常被误认为“精力旺盛”或“性格活泼”,患者可能更早进入婚育阶段。例如,19世纪欧洲某些地区,舞蹈样动作甚至被赋予神秘色彩,间接促进携带者的社会接纳。

2. 案例解析:基因传递的隐形推手
案例:英国HD家系的生育链
黛博拉·古德曼的父亲在33岁确诊HD前已生育5名子女,其中2人遗传了致病基因。尽管后代面临50%的患病风险,但这一家系通过高生育率维持了基因传递。
展望
未来研究可从以下方向突破:
1. 分子机制探索:复旦大学团队发现突变亨廷顿蛋白可能影响大脑皮层发育,或为解释HD基因与神经行为关联提供线索。
2. 演化模拟分析:通过计算模型模拟HD基因在不同历史时期的传播效率,验证生殖优势假说。
3. 伦理与技术平衡:随着基因编辑(如CRISPR)和PGD技术的普及,如何在阻断疾病传播的同时尊重生育权,将成为医学与社会的共同课题。

总结
HD基因的存续揭示了演化医学的核心悖论:某些“有害”基因可能通过间接优势在种群中延续。尽管现代医学已能通过基因检测和辅助生殖技术阻断HD传递,但这一疾病仍提醒我们——生命的演化逻辑远比表象复杂。
参考文献
1.段晓慧. 亨廷顿病的诊断和治疗指南[J]. 中华神经科杂志, 2011.
2. 亨廷顿病致DNA重复突变在实验室被逆转. 2020.
3. 郑州大学第一附属医院. 亨廷顿舞蹈症“双芯试管宝宝”诞生. 2016.
4. 郑利民. 少见病的麻醉(第2版). 2025.
5. 黛博拉·古德曼. 患有遗传病的人可以成为父母吗?. 2024.
6. 李晓江, 杨甦. TRIM37调控突变HTT聚集的机制研究. Science Advances, 2024.
7. 复旦大学. 突变亨廷顿蛋白改变大脑皮层发育轨迹. 2024.
来源: 自创


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 传染病DR.Chen
传染病DR.Chen 
