摘要
人类与疟原虫的斗争持续了数千年,这场博弈不仅塑造了人类的基因库,还催生出许多看似矛盾的疾病,如地中海贫血、蚕豆病(G6PD缺乏症)等。本文通过通俗的语言和生动的案例,揭示疟原虫如何利用人体资源(如铁元素)生存,而人类又如何通过基因突变实现“以病换命”的进化策略。
引言
如果把人体比作战场,疟原虫就是最狡猾的侵略者。这种通过蚊虫传播的寄生虫,每年导致全球2亿人感染,数十万人死亡。但在漫长的对抗中,人类并非毫无还手之力——我们的基因库中隐藏着一些“秘密武器”,例如地中海贫血和蚕豆病相关的基因突变。这些突变看似是疾病的根源,实则是人类进化出的“生存筹码”。
正文
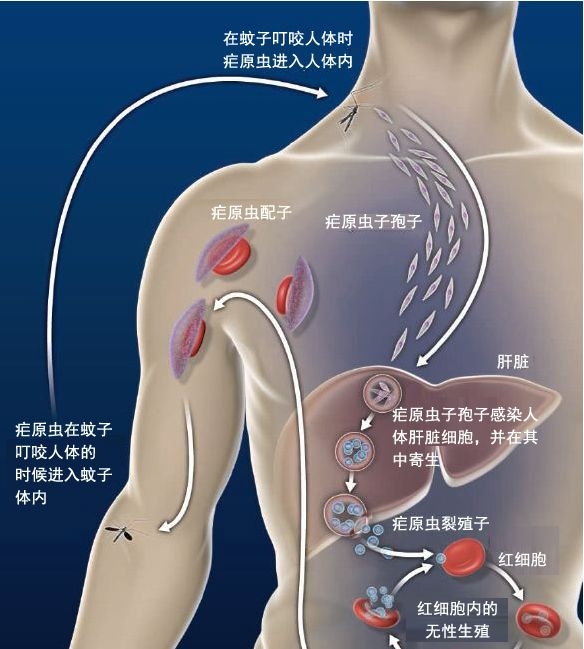
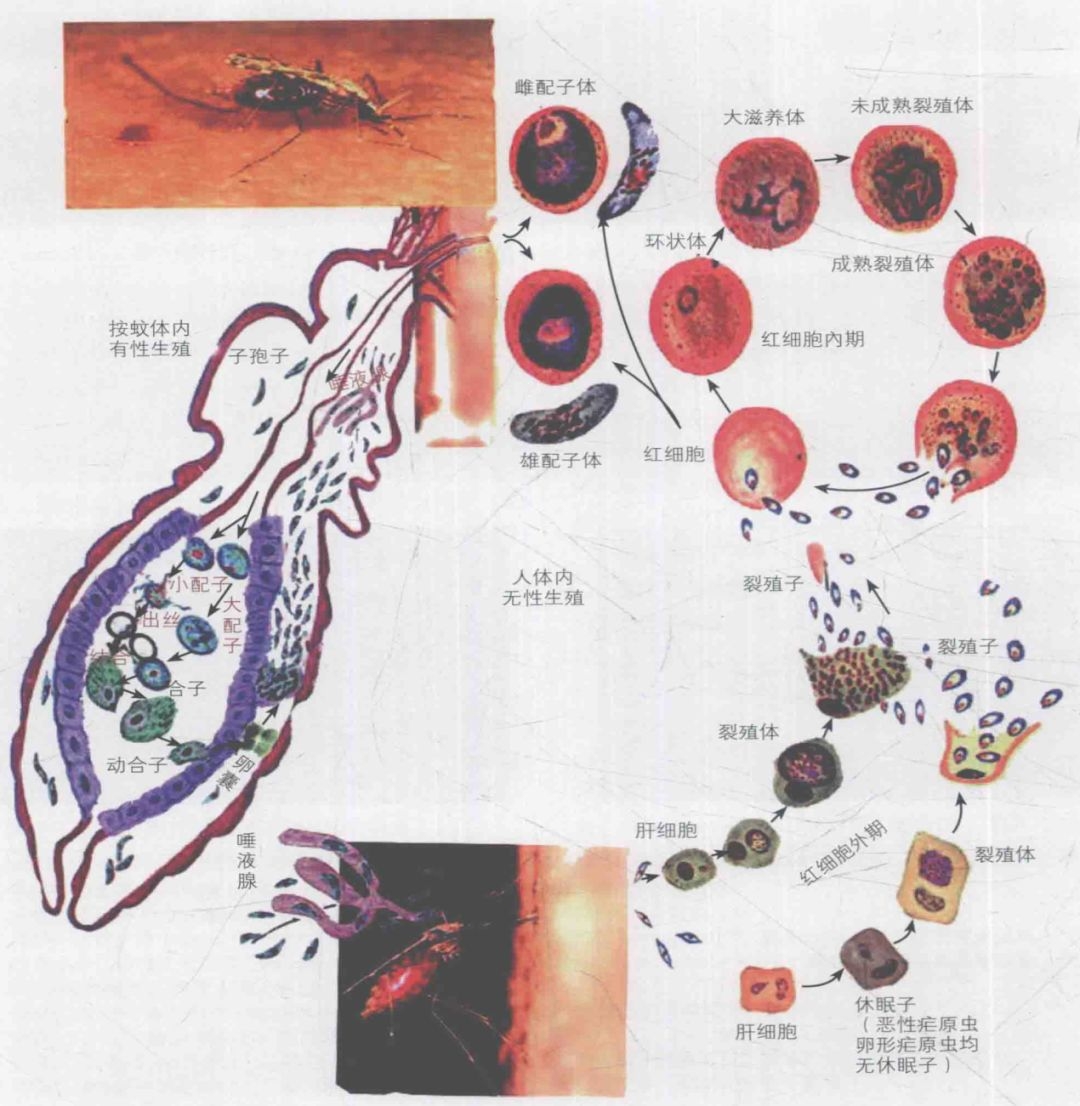
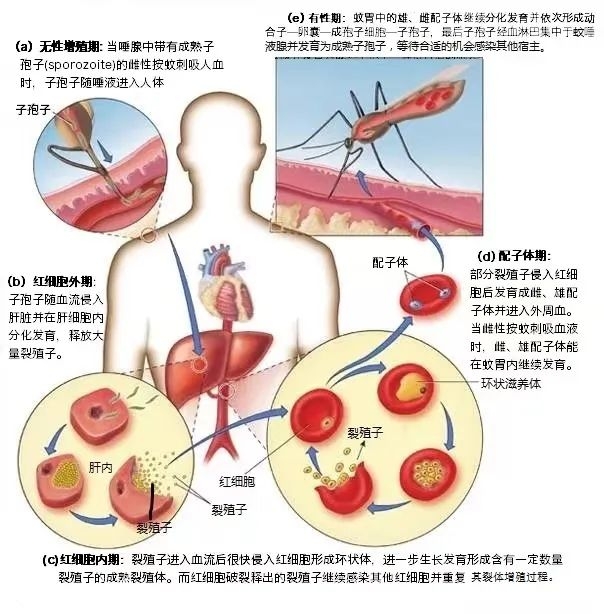
一、疟原虫的“铁饥饿游戏”
疟原虫入侵人体后,会疯狂掠夺红细胞中的血红蛋白,目的是获取其中的铁元素。铁是疟原虫繁殖的关键原料,但人体也有一套“锁铁防御系统”:肝脏分泌的铁调素(Hepcidin)会减少肠道对铁的吸收,并将血液中的铁“锁”进巨噬细胞,让疟原虫“无铁可用”。
案例:在非洲疟疾高发区,许多儿童因缺铁而贫血,但这种贫血反而降低了疟原虫感染的致命性。科学家发现,缺铁人群的疟疾重症率比正常人群低30%。
二、基因突变:进化中的双刃剑
为对抗疟原虫,某些地区的人类进化出了特殊的基因突变,但这些突变也带来了“副作用”。
1. 地中海贫血:残缺红细胞的生存策略
地中海贫血患者的红细胞因血红蛋白合成缺陷而形态异常,恰好能抵抗疟原虫的入侵。疟原虫需要成熟的红细胞才能繁殖,而地中海贫血患者的“次品”红细胞让它无从下手。
案例:泰国一名8岁女孩同时携带地中海贫血基因和正常基因(杂合子)。尽管她常年贫血需要输血,但在疟疾爆发季,她的感染症状明显轻于同龄人。
2. 蚕豆病(G6PD缺乏症):抗氧化防线
蚕豆病患者因缺乏G6PD酶,红细胞容易在氧化压力下破裂(溶血)。但正是这种“脆弱性”,让疟原虫难以在红细胞内稳定生存——因为疟原虫代谢会产生大量自由基,而缺乏G6PD的红细胞会提前自毁,连带消灭寄生虫。
案例:印度一名G6PD缺乏症患者误食蚕豆后突发溶血,但后续检查发现,他血液中的疟原虫载量也同步下降了90%。
三、铁过载:现代人的新困境
在疟疾低发区,地中海贫血和蚕豆病的“保护作用”反而成为负担。更棘手的是,现代人普遍铁摄入过量(如通过营养补充剂),这可能激活潜伏的疟原虫感染。
案例:一项研究显示,服用铁剂的贫血患者感染疟疾后,死亡率比未补铁患者高4倍。
展望
随着基因编辑技术(如CRISPR)的进步,科学家正在探索“精准调控”策略:例如通过抑制铁调素相关基因短暂限制铁元素,或在疟疾流行区针对性修复G6PD基因突变。2023年,首款疟疾疫苗RTS,S已在非洲推广,未来或许能与基因治疗结合,终结这场持续千年的博弈。
总结
地中海贫血、蚕豆病等疾病,是人类与疟原虫博弈留下的“伤疤”,也是进化选择的智慧结晶。它们提醒我们:生命没有完美的解决方案,只有适应环境的权衡。
参考文献
1. Prentice, A. M., et al. (2012). Iron and malaria: a dangerous liaison. The Lancet Infectious Diseases, 12(12), 944-952.
2. Cappellini, M. D., & Fiorelli, G. (2008). Glucose-6-phosphate dehydrogenase deficiency. The Lancet, 371(9606), 64-74.
3. Taher, A. T., et al. (2018). Beta-thalassemia. New England Journal of Medicine, 379(12), 1121-1131.
4. WHO. (2023). World Malaria Report 2023. Geneva: World Health Organization.
来源: 原创


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 传染病DR.Chen
传染病DR.Chen 
