钙(calcium)是一种金属元素,元素符号为Ca,相对原子质量为40.078。钙单质是银白色软金属,暴露在空气中会变成灰白色6,密度为1.54g/cm3,熔点839℃,沸点1484℃7。钙元素位于元素周期表中ⅡA族,属于碱土金属,化学性质活泼。其在空气中燃烧生成氧化钙和氮化钙,与热水剧烈反应释放氢气,可与卤素、硫、氮等非金属单质发生反应。能热还原几乎所有的金属氧化物。1自然界中,钙以碳酸盐、硫酸盐等形式存在,如方解石(CaCO3)、石膏(CaSO4·2H2O)。7
钙是生物体的常量元素之一,在细胞的信号转导等方面发挥着重要作用。人体中99%钙的在骨骼中,钙摄入量低可能会导致骨质疏松等问题。8
金属钙可作为还原剂,用来制备其他金属;用作脱水剂,制造无水酒精;在石油工业中用作脱硫剂;在冶金工业中可用于去氧或去硫。4
研究简史
长期以来,化学家们将从含碳酸钙的石灰石焙烧获得的钙的氧化物当作是不可再分割的物质,直至戴维于1808年开始对氧化钙进行电解。1808年5月,戴维从贝齐里乌斯和蓬丁电解生石灰和水银的混合物中取得钙的实验中获得了启发,他将湿润的生石灰和氧化汞按3比1的比例混合后,放置在一铂片上,与电池的正极相接,然后将混合物做出一个凹陷,灌入水银,插入铂丝,与电池的负极相接,电解之后得到了较大量的钙汞合金。随后,戴维把钙汞合金蒸馏,得到了银白色的金属钙。从此钙被确定为元素,并被命名为calcium。calcium来自拉丁文中表示生石灰的词calx。9
理化性质
物理性质
 钙为银白色柔软轻金属,质比钠硬,比铝、镁软,富延展性,相对密度为1.54g/cm3,熔点839℃,沸点1484℃。常温时,钙晶体呈面心立方体。熔化热9.204kJ/mol,蒸发热189.09kJ/mol,磁化率1.08×10-6,晶格常数a=0.5565nm。3焰色为橙红。7面心立方的α-Ca在464℃转变为六方结晶γ-Ca。21
钙为银白色柔软轻金属,质比钠硬,比铝、镁软,富延展性,相对密度为1.54g/cm3,熔点839℃,沸点1484℃。常温时,钙晶体呈面心立方体。熔化热9.204kJ/mol,蒸发热189.09kJ/mol,磁化率1.08×10-6,晶格常数a=0.5565nm。3焰色为橙红。7面心立方的α-Ca在464℃转变为六方结晶γ-Ca。21
化学性质
钙属于碱土金属,具有碱土金属的化学性质。其外围电子排布为[Ar]4s2。20总的来说化学性质非常活泼,具有很强的还原能力,易与卤素、硫、氮等化合。加热时能还原几乎所有的金属氧化物。易燃。钙在空气中被氧化逐渐变暗,钙愈纯变暗得愈慢。21
氧化反应
金属钙的表面覆盖了一层很薄的氧化物,这使得钙可以免受空气的进一步侵蚀。钙在元素周期表中紧靠在镁的下边,在空气中比镁有更大的反应活性。在空气中点燃金属钙会发生燃烧,生成氧化钙(CaO)和氮化钙(Ca3N2)的混合物。2![]()
![]()
钙和锶和钡一样能生成过氧化物过氧化钙CaO2,但它不能通过氧化钙单质制得。不过它们都能通过液相制备,然后从金属盐溶液中以MO2·8H2O形式沉淀析出。钙、锶和钡的过氧化物随着原子半径的增大其稳定性增强。20
钙与水的反应
钙会与水缓慢地反应,这与在元素周期表中紧靠在钙上方的镁不同,后者实际上不与冷水发生反应。这个反应生成氢氧化钙[Ca(OH)2]和氢气。金属钙会在水中下沉,大约1h之后,会明显出现附着在金属表面的氢气气泡。2![]()
类似地,如果把水换成醇ROH也可以反应,生成醇盐Ca(OR)2。20
钙与卤素单质的反应
金属钙同卤素单质氟气(F2)、氯气(Cl2)、溴单质(Br2)和碘单质(I2)剧烈反应,分别生成二卤化物氟化钙(Ⅱ)(CaF2)、氯化钙(Ⅱ)(CaCl2)、溴化钙(Ⅱ)(CaBr2)和碘化钙(Ⅱ)(CaI2)。同溴和碘的反应需要加热,以确保能够生成产物。2![]()
![]()
![]()
![]()
钙与酸的反应
金属钙能迅速溶解在稀盐酸中,生成氢气和包含钙(Ⅱ)离子的水溶液。2![]()
钙与氢气的反应
钙在加热时能与氢直接化合,生成离子型氢化物氢化钙CaH2,钙比钡更容易反应20:
![]()
CaH2为白色晶体,在干燥空气中稳定,是很强的还原剂,在工业规模的还原反应中用作氢气源,制备硼、钛、钒和其他单质,而且也可用作微量水的干燥剂。在其他化学工业中和科学研究中都有广泛应用。
CaH2受热时可以分解为氢气和游离金属,也易与水反应产生氢气,原因是H-与水解离出的H+结合成为H2 :7![]()
与液氨反应
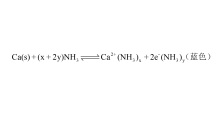 与碱金属一样,钙可以溶于液氨,生成溶剂合电子和钙离子,形成具有较好导电性的深蓝色溶液,含等当量的碱土金属和碱金属液氨溶液,有相同的可见光谱,这种光谱来自与溶剂化电子有关的跃迁20:
与碱金属一样,钙可以溶于液氨,生成溶剂合电子和钙离子,形成具有较好导电性的深蓝色溶液,含等当量的碱土金属和碱金属液氨溶液,有相同的可见光谱,这种光谱来自与溶剂化电子有关的跃迁20:
该溶液可发生与钙金属本身类似的化学反应,但不稳定,特别是过渡金属化合物的存在可催化其分解为氨基化钙。但在无水,不接触空气及不存在过渡金属化合物的条件下,其溶液可在液氨沸点温度(-33℃)下长时间保存。7
与二氧化碳反应
与锶和钡类似,钙在高温下与二氧化碳反应生成碳化钙和氧化钙:20![]()
钙跟碳在高温下反应也能生成碳化钙CaC2。21
钙离子的鉴定
若溶液中含有Ca2+,则加入草酸铵[(NH4)2C2O4]后会生成白色沉淀:7
![]()
相关化合物
氧化钙与氢氧化钙
氧化钙俗称生石灰或石灰,白色结晶固体,是重要的建筑材料,在冶炼厂中用作助熔剂,以除去硫、磷、硅等杂质。在化工中用作制取电石(CaC2)的原料,还可用作生产钙的化学试剂,用于污水处理、造纸等,其产量次于硫酸。
氧化钙可以由它的碳酸盐或硝酸盐加热分解得到,一般是通过加热碳酸钙来制备:
![]()
氧化钙可与水反应生成氢氧化钙(Ca(OH)2),并释放出大量热:
![]()
Ca(OH)2为白色固体,易潮解,是一种强碱,对纤维、皮肤有强烈的腐蚀作用。Ca(OH)2的溶解度不大,且随温度升高而减小。在空气中吸收CO2生成碳酸钙(CaCO3)。7
硫酸钙
二水硫酸钙(CaSO4·2H2O)称为石膏,又称生石膏,白色粉末,微溶于水。在120℃下经煅烧、部分脱水,可得到半水硫酸钙(CaSO4·1/2H2O,又称熟石膏),也为白色粉末,有吸潮性,熟石膏粉末与水混后可形成塑性易浇砌浆体,隔一定时间后硬化成坚固石状体,并微量膨胀、放热,故可用来制造模型、塑像、粉笔和石膏绷带等,还用于生成某些涂料、陶器。二水硫酸钙的工业生产是使用氯化钙与硫酸铁反应。7
制备方法
熔盐电解法和金属热还原法是工业上生产金属钙的主要方法,其所能产出的金属钙的纯度大多在99%~99.9%,但能耗较大,成本较高。高纯金属钙制备的首选方法是真空蒸馏法,该方法可以将工业金属钙转为纯度大于99.999%的高纯金属钙。10
电解法是国内金属工业化生产的主要方法,其原理是基于金属钙与杂质元素不同的电极电位,在电解过程中阳极的选择性放电和阴极的选择性沉积。国内外工业上生产金属钙主要采用氯化钙的熔盐电解。通常是以含钙10%~15%的铜钙合金液体作阴极,石墨电极作阳极,电解氯化钙熔体制取富含钙的钙铜合金。电解过程可在较低的温度(700℃)下进行,获得的钙铜合金含钙范围较宽(65%)。所得钙铜合金经蒸馏后获得金属钙。11
先由石灰石与盐酸反应得到氯化钙:工业上,金属钙可以通过电解熔融的氯化钙(CaCl2)来生产。2
阴极:![]()
阳极:![]()
氯化钙可通过盐酸与碳酸钙的反应而得。氯化钙也是索尔维法的副产品,这是以前生产碳酸钠的方法。2![]()
此外还有另一种制备钙的途径,就是用铝还原氧化钙(CaO),或用金属钠还原氯化钙(CaCl2),这种方法一般用于少量设备。2
![]()
![]()
热还原法主要为铝热还原法和硅热还原法,过程分为石灰石煅烧和石灰的还原两个步骤。将氧化钙、铝粉及矿化剂按配比压制成球,烘干后投入真空电炉中冶炼,使氧化钙还原成钙蒸气,经冷凝后制得金属钙。相比之下,此工艺具有一定的节能效果,且成本相对较低、投资较少。
应用领域
工业用途
金属钙具有高负电性、化学性质活泼等特性,在冶金、石油化工、电池能源等领域均有广泛的应用12。高纯钙是制备许多高纯金属和稀土材料的还原剂,在原子工业和国防军工领域有着不可或缺的作用。1310
金属钙可用作脱氧剂、还原剂、脱硫剂、脱碳剂及油类脱水剂等。也用于生产氢化钙、合金电极、蓄电池及维生素A等。钙用作高温热还原剂,可从氧化物、卤化物中制取金属铬、钍、铀、稀土元素、锆,以及磁性材料钐钴合金、吸氢材料镧镍合金和钛镍合金等。钙还可用作冶炼锡青铜、镍、钢的脱氧剂、有机溶剂的脱水剂、石油精制的脱硫剂、纯制惰性气体(如氦)的除氮剂,分解具有恶臭的噻吩和硫醇。3
Ca–Si合金加入钢中,可以阻止碳化物生成。含钙0.04%的铅钙合金有较高硬度和耐蚀性能,用作电缆线外皮和蓄电池铅板;铝合金中加入钙,可增强塑性。3
生理功能
钙是生物体的常量元素之一,在细胞的信号转导等方面发挥着重要作用。它是一种次级信使,可与多种细胞蛋白相互作用,调节各种生理过程,并在病毒感染等疾病中发挥作用14。骨骼是钙元素的主要储存场所,并在受控条件下将Ca2+离子释放到血液中。血液中的钙一部分以Ca2+离子的形式游离存在,一部分与血清白蛋白等血液蛋白结合。
人体中99%钙的在骨骼中,钙摄入量低可能会导致骨质疏松等问题。日常生活中,如果钙摄入不足,人体就会出现生理性钙透支,造成血钙水平下降。在缺钙初期,可能只会发生可逆性生理功能异常,如心脏出现室性早博、情绪不稳定、睡眠质量下降等反应。当血钙水平下降到一定阈值时,就会促使甲状旁腺分泌甲状旁腺素。甲状旁腺素具有破骨作用,即将骨骼中的钙反抽调出来,维持血钙水平,但骨钙持续大量释出会导致骨质疏松和骨质增生。1516
 钙最容易吸收的形式是钙盐,如碳酸钙或磷酸钙。对于孕妇,则葡萄糖酸钙和乳酸钙更好。老年人更适合乳酸钙、葡萄糖酸钙和柠檬酸钙。富含钙的食物有芹菜、油菜、羊肉和鸡肉,以及各种鱼虾类水产品和大部分干果等。15
钙最容易吸收的形式是钙盐,如碳酸钙或磷酸钙。对于孕妇,则葡萄糖酸钙和乳酸钙更好。老年人更适合乳酸钙、葡萄糖酸钙和柠檬酸钙。富含钙的食物有芹菜、油菜、羊肉和鸡肉,以及各种鱼虾类水产品和大部分干果等。15
分布情况
地壳中钙含量为4.15%,占第五位,也是第三丰富的金属,仅次于铝和铁。主要的含钙矿物有石灰石CaCO3、白云石CaCO3·MgCO3、石膏CaSO4·2H2O、萤石CaF2、磷灰石Ca5(PO4)3F等。蛋壳、珍珠、珊瑚、一些动物的壳体和土壤中都含有钙。海水中氯化钙占0.15%。
计算化学数据
数据21:
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:1
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
安全事宜
注:以下为钙金属粉的安全事项。因为大块的钙金属在正常情况下不太可能燃烧或与水发生强烈反应。只有粉末状钙金属才
来源: 百度百科
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
