氨水为气体氨的水溶液1,主要成分为NH3·H2O,即一水合氨,无色透明且具有刺激性臭味。氨水密度小于水,不稳定,易挥发,见光受热易分解。氨水本身不燃烧、无爆炸危险的液体,从水中分离的氨气具有强烈刺鼻气味,对人体的眼、鼻和皮肤都有一定的刺激性和腐蚀性,且具有燃烧和爆炸危险。
浓氨水通常含氨28%—29%,氨水中的气分子发生微弱水解生成氢氧根离子(OH-)及铵根离子(NH4+),所以呈弱碱性,具有碱的通性,能与酸性物质及多种金属离子如铜、锌等发生反应,生成难溶性弱碱或两性氢氧化物。它是一种重要的化工原料,也是化学实验中氨的常用来源,被广泛应用于农业、工业和科学研究等领域。
相关历史
氨水被发现的具体历史背景和过程并没有详细的记录,但可以追溯到氨气的发现和氨水的制备过程5。
1754年,英国化学家Briestly用硵砂和石灰共热,第一次制出了氨。1787年,Berthollet提出氨是由氮和氢元素组成的。他还研究了氨的性质,发现它易溶于水、可以燃烧,还发现在氨气中通以电火花时,其容积增加很多,而且分解为两种气体;一种是可燃的氢气;另一种是不能助燃的氮气。从而证实了氨是氮和氢的化合物。于是当时的化学家们立即试图通过元素氮和氢合成氨,包括Nernst、Ostwald和Haber等杰出的化学家,以极大的努力专心致力于这个问题的研究。然而却首先遭遇了化学平衡的障碍和争议。正是在这个关键时刻,Haber第一个提出在高压下实现合成氨工业化。
1913年9月9日,世界上第一座合成氨装置投产。之后,合成氨工业迅速发展,到21世纪初,日产合成氨1000t、2000t的装置遍布全球。合成氨成为一个庞大的支柱化学工业。正是这种见解为氨的生产建造实验装置提供了基础,实现了工业史上第一个加压催化过程。这是催化工艺发展史上的一个里程碑,它标志着工业催化新纪元的开端。Haber、Bosch、Mittasch和Ertl这4位伟大的科学家为合成氨工业的创立和发展作出了巨大的贡献。其中,Haber、Bosch和Ertl分别获得了诺贝尔化学奖。
物理性质
物理状态、外观:极易挥发的无色氨水溶液,有刺鼻气味
pH: 11.7(1%溶液) 2
熔点(℃):-77
沸点(℃):38
相对密度(水=1):0.91
饱和蒸汽压(kPa):1.59(20℃)
相对蒸气密度(空气=1):0.6
爆炸上限%(V/V):33.6 %(V)
爆炸下限%(V/V): 15.4 %(V)
溶解性:溶于水、乙醇
水溶性:
单位 |
温度/℃ | |||||||||||
0 |
5 |
10 |
15 |
20 |
25 |
30 |
40 |
50 |
60 |
80 |
100 | |
q |
87.5 |
77.1 |
67.9 |
59.7 |
52.6 |
46.2 |
40.3 |
30.7 |
22.9 |
16.6 |
15.4 |
7.4 |
q-是在所给的温度下当气体总压力(气体分压与吸收温度下液体的饱和蒸汽压之和)为760mmHg时,100g纯 溶剂所吸收的气体克数6。
化学性质
腐蚀性
氨水有一定的腐蚀作用,碳化氨水的腐蚀性更加严重。对铜的腐蚀比较强,钢铁比较差,对水泥腐蚀不大。对木材也有一定腐蚀作用。属于危险化学品,危规号82503。
弱碱性
氨水是由氨气溶于水形成的。氨水中存在以下化学平衡:
NH3+H2O==NH3·H2O(可逆反应);
NH3·H2O==NH4++OH-(可逆反应);电离常数:K=1.8 10-5(25℃)7。
因此仅有一小部分氨分子与水反应而成铵离子NH4+和氢氧根离子OH-,故呈弱碱性。
它具有碱的通性,可以与酸发生中和反应,生成盐和水。
①能使无色酚酞试液变红色,能使紫色石蕊试液变蓝色,能使湿润红色石蕊试纸变蓝实验室中常用此法检验NH3的存在。
②能与酸反应,生成铵盐。浓氨水与挥发性酸(如浓盐酸和浓硝酸)相遇会产生白烟
NH3+HCI=NH4CI(白烟)
NH3+HNO3=NHNO3(白烟)
而遇不挥发性酸(如硫酸、磷酸)无此现象。因此实验室中可用此法检验水中氨分子的存在
工业上,利用氨水的弱碱性来吸收硫酸工业尾气,防止污染环境。
SO2+2NH3·H2O===(NH4)2SO3+H2O
(NH4)2SO3+SO2+H2O=2NH4HSO3
不稳定性
一水合氨不稳定,见光受热易分解而生成氨和水。
NH3·H2O =NH3↑+H2O
沉淀性
氨水是很好的沉淀剂,它能与多种金属离子反应,生成难溶性弱碱或两性化物。例如:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
生成的Al(OH)3沉淀难溶于过量氨水。
Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
生成的白色沉淀易被氧化生成红褐色沉淀。
4Fe(OH)2+O2+H2O=4Fe(OH)3(红褐色)
利用此性质,实验中可制取Al(OH)3、Fe(OH)3、Fe(OH)2等
还原性
氨水表现出弱的还原性,可被强氧化剂氧化。如氨水可与氯水发生反应:
3Cl2+8NH3·H2O=6NH4Cl+N2+8H2O
也可与KMnO4反应。
氧化性
氨分子中+1氧化态的氢则表现出弱氧化性,可将强还原剂氧化。如液氨把碱金属化:
2NH3+2Na=2NaNH2+H2↑
此外,氨水还具有还原性,可以在一定条件下被氧化为氮气或其他含氮化合物。这些独特的化学性质使得氨水在多个领域都有广泛的应用。
络合性
氨水与Ag+、Cu2+、Cr3+、Zn2+等离子能发生络合反应,当氨水少量时,产生不溶性弱碱,当氨水过量时,不溶性物质又转化成络离子而溶解。
Ag2O+4NH3·H2O===2[Ag(NH3)2]++2OH-+3H2O
实验室中用此反应配制银氨溶液)
Zn(OH)2+4NH3·H2O===[Zn(NH3)4]2++2OH-+4H2O
可用此反应来鉴别两性氢氧化物氢氧化铝和氢氧化锌。
Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2+(深蓝色)+ 2OH-+4H2O
氨水的制备
1、氨水可以通过多种方法制备,其中最常见的方法为哈伯–博什过程,其制备过程如下19:
(1)在压温下,将氮气和氢气通入铁催化剂中;
(2)氮气和氢气在铁催化剂中发生反应,生成氨气;
(3)将生成的氨气通过冷却并延长通气时间使其溶于水中,即可制得氨水。
2、以液态氨为原料,在常温下挥发出氨气,洗涤去除氨中杂质,通入气体吸收塔,用高纯水吸收氨,再经微孔滤膜处理即可19。
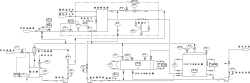
下图为氨水制备流程图20
氨水的检测
滴定法
对于工业氨水的检测方法是依据HG/T5353-2018《工业氨水》,其标准中要求氨水氨(NH3)含量≥20.0%;色度/黑曾≤80;蒸发残渣≤0.2%。测定氨含量用盐酸标准滴定溶液滴定试样,甲基红-亚甲基蓝为指示剂判断终点的滴定法:色度的检测是目视比较样品与铂-钴标准溶液,判断样品的色度。蒸发残渣是用瓷蒸发皿在水浴上蒸干10g试样,然后置于恒温干燥箱干燥至恒重8。
色谱法
使用快速检测氨水含量,以GDX104 填充柱分离,热导检测器检测,外标法定量。方法标准曲线相关系数r=0.99915,相对标准偏差RSD为2.04%,加标回收率96.6%-100.02%。该方法简单、快速、准确度好9。
应用
农业领域
氨水主要是做肥料,适用于各种土壤和作物10。氨水能被作物安全吸收的浓度为<0.05%,为了减少氨的挥发和降低碱性,农业上有时在氨水中通入二氧化碳,制成碳化氨水使用,含氨量一般大于15%,其作用和普通氨水相同,但便于使用11。
工业领域
在工业上,氨水用于制造各种化学品,如尿素、硝酸铵、氯化铵等。纺织工业用于洗涤羊毛等物品,制药、制革、橡胶和油脂碱化,以及瓶胆镀银等都要用到氨水12。
电子工业
电子级氨水由工业合成氨提纯得到,在集成电路制造中主要用于硅片清洗、腐蚀工序中,可与过氧化氢、氢氟酸配合使用13。
日常生活
除了工业应用外,氨水在我们的日常生活中也扮演着重要角色。例如,在清洁领域,氨水可以作为玻璃清洁剂、金属清洁剂等多种用途。此外,氨水还可以用于制作某些化妆品、洗发水和烫发剂等。医学上可以治疗昏厥,并用作皮肤刺激剂和消毒药14。
实验室
在化学实验室中,氨水常用作碱性试剂、沉淀剂、配位剂等,用于制备各种化学试剂和进行化学反应。
环保行业
氨水可作为空气污染物治理的中性化剂。在氨氮废水处理中,氨水也是常用的中和剂15。
其他用途
1、氨水吸收式制冷系统
氨吸收式制冷系统可以制取0℃以下低温冷量,同时它具有废热综合利用、系统运行平稳可靠、噪声小、维修简单、操作方便等优点,在工业制冷和空调系统领域具有较好的应用前景16。
2、氨水吸收CO2
气候变化引起国际社会越来越多的关注,二氧化碳的减排已成为迫切需要解决的问题。CO2与氨可以在不同温度条件下进行化学反应,在常压、室温条件下,主要生成NH2COONH4,NH2COONH4很容易溶解于水生成(NH4)2CO317。
3、新型燃气–氨水蒸汽功冷联供联合循环
以氨水代替水作为底循环工质,可以有效减少余热锅炉中换热过程的不可逆损失,使得联合循环系统性能得以提高。采用氨水工质的动力正循环和制冷逆循环在运行方式、工作温度区间和系统输出等方面存在广泛的互补性。在氨水工质动力循环的加热过程中,氨水变温蒸发的特性使得在保持适当换热温差等约束条件的情况下,氨水浓度的提高有利于改善其与热源间的热匹配18。
稳定性和反应性
稳定性:稳定
危险反应:与酸类等禁配物发生反应
避免接触的条件:受热
禁配物:酸类、铝、铜。危险的分解产物:氨
毒理学数据
急性毒性 |
LD50: 350mg/kg(大鼠经口)。 |
皮肤刺激或腐蚀 |
家兔经皮:250ug,重度刺激。 |
眼睛刺激或腐蚀 |
家兔经眼:44rg,重度刺激。 |
潜在的健康影响 |
吸入后对鼻、喉和肺有刺激性,引起咳嗽、气短和喘息等;重者发生喉头水肿、肺水肿及心、肝、肾损害。溅入眼内可造成灼伤。皮肤接触可致灼伤。口服灼伤消化道。 |
RTECS号码: |
BQ9625000 |
生态学数据
对鱼类的毒性 |
TLm: 8.2mg/L(96h)(黑头呆鱼);3.4mg/L(96h)(蓝鳃太阳鱼) LC50: 0.24~0.093mg/L(48h)(蓝鳃太阳鱼);0.45mg/L(96h)(银大马哈鱼) |
对水蚤和其他水生无脊椎动物的毒性 |
LC50: 0.66mg/L(48h)(水蚤) |
操作处置与储存
处理
操作处置注意事项:严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴导管式防毒面具,戴化学安全防护眼镜,穿防酸碱工作服,戴橡胶手套。防止蒸气泄漏到工作场所空气中。避免与酸类、金属粉末接触。搬运时要轻装轻卸,防止包装及容器损坏。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存
储存条件:储存于阴凉、通风的库房。远离火种、热源。库温不超过32℃,相对湿度不超过 80%。保持容器密封。应与酸类、金属粉末等分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。
包装材料:依据法律。
废弃处置
废弃化学品:中和、稀释后,排入废水系统。
污染包装物:将容器返还生产商或按照国家和地方法规处置。
废弃注意事项:处置前应参阅国家和地方有关法规。
环境危害
对水生生物毒性极大.由于其水溶性,可能在环境中迁移.产品溶于水,在水系统中可能会蔓延。
防护措施
1、职业接触限值: 中国:PC-TWA:20mg/m3;PC-STEL:30mg/m3
美国(ACGIH):TLV-TWA:25ppm;TLV-STEL:35ppm
2、监测方法:空气中有毒物质测定方法:纳氏试剂分光光度法
3、技术控制:尽可能安装封闭体系或局部排风系统。同时安装淋浴器和洗眼。
4、个体防护设备:
眼面防护 |
佩戴过滤式防毒面具(全面罩)。 |
手部防护 |
戴橡胶手套。 |
皮肤和身体保护 |
穿防酸碱工作服。 |
呼吸系统防护 |
可能接触其蒸气时,应该佩戴过滤式防毒面具(全面罩)。 |
消防措施
1、灭火方法或灭火剂:用水、雾状水、砂土灭火。
2、灭火注意事项及措施: 消防人员必须穿全身耐酸碱消防服、佩戴空气呼吸器灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。
3、源于此物质或混合物的特别的危害:特别危险性:易放出氨气,温度越高,放出气体速度越快,可形成爆炸性气氛。燃烧生成有害的氨氧化物。
应急处理
泄漏应急处理
1、个人防护措施,防护用具:使用个人防护用品。远离溢出物/泄露处并处在上风处。确保足够通风。
2、紧急措施:泄露区应该用安全带等圈起来,控制非相关人员进入。
3、环保措施: 小心,切勿排入河流等。因为考虑对环境有负面影响。
4、 控制和清洗的方法和材料:用合适的吸收剂(如:旧布,干砂,土,锯屑)吸收泄漏物。一旦大量泄漏,
筑堤控制。附着物或收集物应该立即根据合适的法律法规废弃处置。
急救措施
1、吸入:将受害者移到新鲜空气处,保持呼吸通畅,休息。立即呼叫解毒中心/医生。
2、皮肤接触:立刻脱掉所有受沾染的衣物。用大量流动清水彻底冲洗至少15min。立刻呼叫中毒控制中心
或者医生。受沾染的衣物清洗后方能再次使用。
3、眼睛接触:用水小心冲洗几分钟。用流动清水或生理盐水彻底冲洗5~10min。如果戴有隐形眼镜且可方便
取出,取出隐形眼镜。继续冲洗。立刻呼叫中毒控制中心或者医生。
4、吞咽:漱口。请勿催吐。立刻呼叫中毒控制中心或者医生。
5、紧急救助者的防护:救援者需要穿戴个人防护用品,比如橡胶手套和气密性护目镜。
运输信息
|
含氨量高于10%,但不超过35% |
含氨量高于35%,但不超过50%) |
含氨>50% |
联合国危险货物编号(UN号) |
2672 |
2073 |
3318 |
联合国运输名称 |
氨溶液 |
氨溶液 |
氨溶液 |
联合国危险性类别 |
8 |
2.2 |
2.3,8 |
包装类别 | Ⅲ类包装 |
Ⅲ类包装 | Ⅲ类包装
|
包装标志 |
|
|
|
海洋污染物 |
是 |
是 |
是 |
运输注意事项:
铁路运输时,钢桶包装的可用敞车运输。起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与酸类、金属粉末、食用化学品等混装混运。运输时运输车辆应配备泄漏应急处理设备。运输途中应防曝晒、雨淋,防高温。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。
法规信息
来源: 百度百科
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科