氯化铁,化学式为FeCl3,外观为黑棕色结晶(亦有薄片状),在潮湿的空气中易潮解,在酸度较小的溶液中易水解,生成氢氧化铁胶体,易溶于水、甲醇、乙醇、丙酮、乙醚,不溶于甘油(丙三醇),溶于水时会释放大量热量,形成咖啡色或棕黄色的酸性溶液,可从溶液中析出带有结晶水的六水合三氯化铁(FeCl3×6H2O)。
氯化铁是一种重要的铁盐,被广泛应用于金属刻蚀、污水处理、凝聚剂、催化剂、氧化剂、媒染剂、药物等领域。
可以放在制备部分目前,氯化铁的工业生产有高温氯化法(火法)、盐酸法、一步氧化法和连续反应法;提纯除杂有重结晶法、利用单质铁还原法、调节pH值沉淀法、硫化物沉淀法以及萃取法。
理化性质
物理性质
氯化铁的外观为黑棕色结晶(亦有薄片状),易溶于水(室温下的溶解度约为480 g/L)、甲醇、乙醇、丙酮、乙醚,不溶于甘油(丙三醇)。
名称 | 单位 | 数值 |
摩尔质量 | kg/kmol | 162.204 |
密度 | g/cm³ | 2.8 |
熔点 | ℃ | 304 |
沸点 | ℃ | 316 |
偶极矩 | D | 1.28 |
Pitzer偏心因子 | — | 0.174 |
临界温度 | ℃ | 675 |
临界压力 | MPa | 4.3 |
临界体积 | m³/kmol | 0.1 |
临界压缩因子 | — | 0.2 |
标准摩尔生成吉布斯函数 | kJ/mol | -334.00 |
标准摩尔生成焓 | kJ/mol | -399.49 |
标准摩尔熵 | kJ×kmol-1×K-1 | 142.3 |
熔点下的熔化焓 | kJ/mol | 43.095 |
参考资料来源:1 | ||
此外,氯化铁在295 K下的磁矩为5.73 BM(与场强无关),在盐酸水溶液中的室温磁矩为5.94 BM,六水合物有相似大小(5.95 BM)的磁矩2。
化学性质
受热分解
氯化铁在真空中加热至200 ℃可分解为氯化亚铁和氯气。
2FeCl3 → 2FeCl2 + Cl2↑
注:三溴化铁更易分解,三氯化铁仅局部分解3。
碱性沉淀
Fe3+离子在碱性溶液中易产生氢氧化铁红褐色或红棕色沉淀,以一元弱碱氨水、一元强碱氢氧化钠以及二元强碱氢氧化钡溶液为例。
FeCl3 + 3NH3×H2O → Fe(OH)3↓+ 3NH4Cl
FeCl3 + 3NaOH → Fe(OH)3↓+ 3NaCl
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3↓+ 3BaCl2
Fe3+ + 3NH3×H2O → Fe(OH)3↓+ 3NH4+
Fe3+ + 3OH- → Fe(OH)3↓
注:对于在水溶液中不完全解离的弱碱(弱电解质),在书写离子方程式时,该物质的分子式不可拆写为离子。
氧化还原反应
氯化铁中铁元素为III价,具有一定的氧化性,在25 ℃、100 kPa、Pt电极下与二价铁离子的标准电极电势为+ 0.771 V4。
![]()
![]()
可被还原性物质还原为二价铁。以还原剂二氧化硫、亚硫酸、硫化氢、碘化氢、硫化铵、亚硫酸钠、硫代硫酸钠、羟胺、氯化亚铜、单质铜、二氯化锡、氯化铵(高温、密闭容器)、草酸为例,Fe3+均被还原为Fe2+。
FeCl3 + SO2 + 2H2O → 2FeCl2 + H2SO4 + 2HCl
2FeCl3 + 2H2SO3 + H2O → 2FeSO4 + 6HCl
FeCl3 + H2S → 2FeCl2 + S↓+2HCl
2FeCl3 + 2HI → 2FeCl2 + 2HCl + I2
2FeCl3 + 3(NH4)2Sx → Fe2S3↓+ 6NH4Cl + 3Sx-1
2FeCl3 + 2Na2SO3 → Na2S2O6 + 2NaCl + 2FeCl2
2FeCl3 + 2Na2S2O3 → 2NaCl + 2FeCl2 + Na2S4O6
4FeCl3 + 2NH2OH → 4FeCl2 + 4HCl + N2O↑+ H2O
FeCl3 + CuCl → FeCl2 + CuCl2
2FeCl3 + Cu → 2FeCl2 + CuCl2
2FeCl3 + SnCl2 → 2FeCl2 + SnCl4
6FeCl3 + 2NH4Cl → 6FeCl2 + 8HCl + N2↑
2FeCl3 + HOOC-COOH → 2FeCl2 + 2HCl + 2CO2↑
其中,对于氯化铁和单质铜的反应,现象为溶液由黄色变为蓝色(Fe2+离子的浅绿色被蓝色掩盖),是氯化铁可被用于刻蚀铜电路板的原理。
氯化铁还可与单质铁(还原铁粉)发生归中反应,+3价和0价的铁元素归中为+2的中间价态,溶液由黄色变为浅绿色。
2FeCl3 + Fe → 3FeCl2
注:归中反应是指同种元素不同价态物质之间的氧化还原反应,参与反应的元素的两种化合价(一高一低)会向中间靠拢,归中为同一数值,与此相对应的是歧化反应,即一种化合价歧化为一高一低的两种化合价。
若与强氧化剂反应,+3价的铁元素可被氧化为更高的+6价,以30%的双氧水为例,在碱性环境下反应可生成深红色的高铁酸钾2。
2FeCl3 + 3H2O2 + 10KOH → K2FeO4 + 6KCl + 8H2O
水解反应
由于氯化铁是强酸HCl和弱碱Fe(OH)3发生中和反应所生成的盐,因此,Fe3+离子在水溶液中会水解形成强酸性的溶液,不仅能溶解电正性金属(如镁、铝)而放出H2,还能与碱金属碳酸盐(如碳酸钠)溶液反应放出CO2。
Fe3+ + 3H2O Fe(OH)3 + 3H+
FeCl3 + 3H2O Fe(OH)3 + 3HCl
注:鉴于水解是可逆反应,且生成的Fe(OH)3量极少,无法以沉淀的形式为肉眼所见,因此可不书写沉淀符号。
因此,欲从FeCl3水溶液中获取溶质,无法通过简单的蒸发溶剂来实现,而需要在氯化氢氛围中蒸发,目的是抑制Fe3+离子的水解,否则只能得到氢氧化铁,或由氢氧化铁受热脱水而成的氧化铁。
FeCl3×6H2O → Fe(OH)Cl2 + HCl + 5H2O
Fe(OH)Cl2 +2H2O → Fe(OH)3 + 2HCl
2Fe(OH)3 → Fe2O3 + 3H2O
此外,若向沸水中滴加FeCl3(aq.)可制得红棕色的氢氧化铁胶体。
其次,FeCl3×6H2O盐的晶体中含有六水合铁离子,即[Fe(H2O)6]3+,能存在于pH = 0(1 mol/L)的强酸溶液,但在稀溶液中的酸性可表示为脱质子作用,即形成水合氢离子。
[Fe(H2O)6]3+ + H2O [Fe(OH)(H2O)5]2+ + H3O+ Kh1 = 1.0×10-3.5
[Fe(OH)(H2O)5]2+ + H2O [Fe(OH)(H2O)4]+ + H3O+
若增大pH,[Fe(OH)(H2O)4]+络合离子会进一步缩聚为红棕色的氢氧化铁胶状溶液,直至pH = 4~5可形成水合沉淀物,即Fe(OH)3×3H2O(水合氢氧化铁),或由FeO(OH)和4H2O形成的水合氧化铁5。
此外,氯化铁与强碱弱酸盐,如碳酸钠、硫化钠、碳酸氢铵等可发生双水解反应,亦称为“互促水解”。
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓+ 3CO2↑+ 6NaCl
2FeCl3 + 6NH4HCO3 → 2Fe(OH)3↓+ 3CO2↑+ 6NH4Cl
2FeCl3 + 3Na2S + 6H2O → 2Fe(OH)3↓+ 3H2S↑+ 6NaCl
2Fe3+ + 3CO32- + 3H2O → 2Fe(OH)3↓+ 3CO2↑
2Fe3+ + 6HCO3- → 2Fe(OH)3↓+ 6CO2↑
Fe3+ + 3S2- + 6H2O → 2Fe(OH)3↓+ 3H2S↑
注:由于双水解反应不可逆程度高,因此可逆符号可用单向箭头代替。
显色反应
以苯酚(石炭酸)为例,与三氯化铁的发生络合反应可生成有色络合物,是部分酚类、酮类(如戊二酮)能被FeCl3溶液定性鉴定的原理。
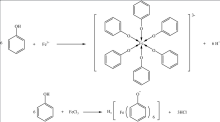
实际上,具有羟基与sp2杂化碳原子相连结构(-C=C-OH)的化合物,能与FeCl3溶液形成有特殊颜色的络合物,如苯酚、均苯三酚显紫色,邻苯二酚、对苯二酚显绿色,甲苯酚显蓝色,对硝基苯酚显棕色,亦有些酚类(如三硝基苯酚、邻硝基苯酚)不显色6。
其次,氯化铁可分别与硫氰化钾或硫氰化铵、亚铁氰化钾(俗称“黄血盐”)生成血红色、深蓝色的络合物,也是Fe3+离子鉴定的原理。
FeCl3 + 3KSCN → 3KCl + Fe(SCN)3↓
FeCl3 + K4[Fe(CN)6] → 3KCl + KFe[Fe(CN)6]↓
注:KFe[Fe(CN)6]深蓝色络合物的俗称为普鲁士蓝。
置换反应
以过量的单质锌、镁、铝(棒)为例,置换氯化铁溶液的单质铁的现象均为金属棒逐渐溶解,溶液逐渐由黄色变为无色,金属棒上析出银白色固体。
3Zn + 2FeCl3 → 3ZnCl2 + 2Fe
3Mg + 2FeCl3 → 3MgCl2 + 2Fe
Al + FeCl3 → AlCl3 + Fe
3Zn + 2Fe3+ → 3Zn2+ + 2Fe
3Mg + 2Fe3+ → 3Mg2+ + 2Fe
Al + Fe3+ → Al3+ + Fe
实际上,一方面,置换反应也是氧化还原反应,即利用活泼金属的还原性将Fe3+还原为0价的单质铁;另一方面,单质钾、钙、钠、钡无法与氯化铁溶液产生上述反应。
需要注意的是,若不采用过量的单质锌、镁、铝,则置换反应的现象却是溶液金属棒逐渐溶解,溶液由黄色逐渐变为浅绿色,金属棒析出银白色固体。
Zn + 2FeCl3 → ZnCl2 + 2FeCl2
Mg + 2FeCl3 → MgCl2 + 2FeCl2
Al + 3FeCl3 → AlCl3 + 3FeCl2
Zn + 2Fe3+ → Zn2+ + 2Fe2+
Mg + 2Fe3+ → Mg2+ + 2Fe2+
Al + 3Fe3+ → Al3+ + 3Fe2+
究其原因,是根据金属活动性顺序表可知,位于铁之前的金属单质可进一步置换亚铁盐溶液中的铁单质。7

其它性质[3]
向FeCl3水溶液中加入氧化锌固体可产生红棕色的氢氧化铁沉淀,本质上是氧化锌消耗由Fe3+离子水解产生的H+,进而使水解平衡正向移动,氧化汞、氧化铜、氢氧化铜、碱式碳酸铜均有类似的反应。
FeCl3 + ZnO + 3H2O → 2Fe(OH)3↓+ 3ZnCl2
FeCl3和浓的醋酸溶液反应可生成HCl。
FeCl3 + 2CH3COOH(浓) → Fe(CH3COO)Cl + 2HCl
FeCl3和磷酸氢钠、醋酸钠的溶液反应可生成磷酸铁和醋酸。
FeCl3 + Na2HPO4 + CH3COONa → FePO4 + CH3COOH + 3NaCl
FeCl3和磷酸氢钠或磷酸二氢钠溶液均反应可生成黄色的磷酸铁沉淀和HCl,磷酸铁在溶液中存在平衡(转化为Fe3+)。
FeCl3 + 2Na2HPO4 FePO4↓+ 3NaCl + NaH2PO4
FeCl3 + NaH2PO4 FePO4↓+ NaCl + 2HCl
FePO4 + H+ Fe3+ + HPO42-
FeCl3与浓的草酸钾溶液共热,除了被还原为FeCl2,还会产生铁钾络合物沉淀(草酸铁钾),络合离子和H+作用可生成草酸。
3FeCl3 + 4K2C2O4(浓) → K3[Fe(C2O4)3]↓+ 5KCl + 2FeCl2 + 2CO2↑
[Fe(C2O4)3]3- + 6H+ → Fe3+ + 3H2C2O4
FeCl3与草酸铵溶液反应可生成溶于水的草酸铁铵。
FeCl3 + 3(NH4)2C2O4 → (NH4)3[Fe(C2O4)3] + 3NH4Cl
FeCl3与丁二酸钠溶液反应可生成淡棕色沉淀和丁二酸。
2FeCl3 + 3C2H4(COONa)2 + 2H2O → 6NaCl + 2C2H4(COO)Fe(OH)↓+ C2H6O2
FeCl3与甲酸钠溶液反应可生成易溶于水的甲酸铁,再将草酸铁溶液煮沸可生成甲酸。
FeCl3 + 3HCOONa → Fe(HCOO)3 + 3NaCl
Fe(HCOO)3 + 2H2O → Fe(HCOO)(OH)2 + 2HCOOH
类似地,FeCl3与乙酸钠溶液反应可生成易溶于水的乙酸铁(红色),将乙酸铁溶液煮沸可生成乙酸和棕色沉淀。
FeCl3 + 3CH3COONa → Fe(CH3COO)3 + 3NaCl
Fe(CH3COO)3 + 2H2O → Fe(CH3COO)(OH)2↓+ 2CH3COOH
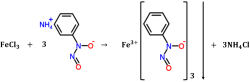
试铜铁灵(cupferron),又称“铜铁试剂”、N-亚硝基苯胲铵,与氯化铁溶液可反应生成淡红棕色沉淀。
FeCl3在氢氟酸气流中可转化为氟化铁2。
FeCl3 + 3HF → FeF3 + 3HCl
合成
高温氯化法
高温氯化法又称为火法或燃烧法,指在燃烧炉内将铁屑加热至600~800 ℃,再通入干燥氯气进行氯化反应,可生成气态的三氯化铁,经冷却后得到固体三氯化铁。火法对化工设备要求较高,而且反应放热量较大,对移热的控制提出了较高的要求,成本较高8。
2Fe + 3Cl2 → 2FeCl3
盐酸法
盐酸法又称水法或两步法,指铁屑先与稀盐酸反应生成氯化亚铁,再通入氯气将其氧化为三氯化铁。
Fe + 2HCl → FeCl2 + H2↑
Cl2 + 2FeCl2 → 2FeCl3
一步氯化法
一步氯化法又称一步法或直接法,指将铁屑投入盛有水的反应釜中,再向其中通入氯气,即可生成三氯化铁溶液,直接法反应速度较为缓慢,效率较低9。
连续反应法
连续反应法可大致分为两步,具有工艺简单、反应条件温和等优点。首先,铁屑先与三氯化铁溶液在反应槽中发生归中反应生成FeCl2溶液;其次,将氯化亚铁溶液泵入氯化塔塔顶,与来自塔底通入的氯气在氯化塔中逆流接触反应生成FeCl3溶液;最后,一部分三氯化铁溶液回流至反应槽与铁屑循环反应,进而使三氯化铁的生产得以连续,而另一部分则作为产品送至储槽9。
制备
重结晶法
鉴于三氯化铁熔点较低(易升华),可加热三氯化铁固体至37 ℃以上使其变为液体,冷却后可进行重结晶操作,可加入晶种以提高结晶速度,否则工业生产效率低下,影响经济效益,最终的产品可达到试剂级要求10。
调节pH值沉淀法
根据各种金属离子形成氢氧化物沉淀的pH值不同的原理,可通过碱、金属氧化物等碱性化合物调节溶液的酸度,使Cr3+、Be2+、Cu2+、Zn2+、Sn2+、Pb2+等离子以氢氧化物的形式沉淀。由于Fe3+在pH>3时即开始水解,而Fe2+直至pH>6.5时才开始水解,加上pH值越高越有利于金属离子的沉淀,因此,可待其它金属离子沉淀完全后,由氧化剂将Fe2+氧化为Fe3+,从而实现三价铁盐的制备。
硫化物沉淀法(S2+与三价铁反应)
根据杂质金属离子的溶度积Ksp值,可在调节pH值后加入硫化物,使杂质离子与S2-结合为难溶物。其中,Cu2+、Ni2+、Co2+、Al3+、Cd2+等离子的去除效果较好,浓度一般可降至2 ppm以下,镍离子可降低至检测下限乃至未检出,但对Mn2+离子的去除效果不佳11。
当产品对钾、钠、镁、钙、锰等金属要求不高,且杂质元素高于2000 ppm时才会考虑使用硫化物除杂,适用于杂质含量高而对产品纯度要求不高的情形。
萃取法
得益于特殊的电子排布和电子云性质,Fe3+离子具有良好的络合能力,而萃取法的出发点是萃取剂应尽可能与Fe3+离子可形成唯一、稳定的络合物,即在特定的条件下,萃取剂才表现出对Fe3+离子的专一性。
胺类萃取剂,如三辛铵(TOA)、N,N-二(2-乙基己基)乙酰胺、三辛癸烷基叔胺(N235)、N,N-二(1-甲基庚基)乙酰胺(N503),由于分子结构中的氮原子的孤对电子可和羰基发生p-π共轭效应,使羰基氧原子上的电荷密度增加,因此,羰基的氧原子对氢离子或金属离子具有较好的配位能力。
以乙酸丁酯为例,由于氧原子具有未成键的孤对电子,可与H3O+作用生成乙酸丁酯正离子,可与金属配位阴离子缔合形成易溶于该溶剂的中性分子12,萃取由此可完成,乙酸丁酯从HCl中萃取Fe3+的原理如下12。
CH3COOC4H9 + H+ → [CH3COOC4H10]+
Fe3+ + 4Cl- → [FeCl4]-
[CH3COOC4H10]+ + [FeCl4]- → CH3COOC4H10FeCl4
由此可知,Fe3+和Cl-形成的络合物[FeCl4]-相较游离态的Fe3+更容易被萃取,因此,盐酸的加入量与萃取效率呈正相关。
应用
凭借氧化性和在水溶液中的絮凝机制,氯化铁主要用于金属蚀刻和污水处理。
金属蚀刻:铜、不锈钢、铝等材料的刻蚀,其中还包含了五金刻蚀,刻蚀产品包括眼镜架、钟表、电子器件、铭牌标牌等;
污水处理:低油度的原水处理、高毒、高氮含量和高COD(化学需氧量)的废水处理等13,具有效果好、价格便宜等优点,但同时亦会导致水色泛黄;
染料工业:氯化铁亦可用于印染滚筒刻花、电子工业线路板及荧光数字筒生产以及印地科素染料染色时的氧化剂等;
建筑工业:可用于制备混凝土,以增强混凝土的强度、抗腐蚀性和防水性,也能与氯化亚铁、氯化钙、氯化铝、硫酸铝、盐酸等配制成泥凝土防水剂;
无机工业:用于制造其他铁盐、墨水或催化剂(如催化H2O2分解);
冶金工业:用作提取金、银的氯化浸取剂;
有机工业:用作催化剂(如酯化反应)、氧化剂和氯化剂;
玻璃工业:用作玻璃器皿热态着色剂;
制皂工业:用作肥皂废液回收甘油的凝聚剂;
新能源:锂离子电池正极材料磷酸铁锂(LiFePO4)的铁源14。
检验
方法
原子吸收法 《食品中添加剂的分析方法》,马家骧等译。比色法(EPA方法 9250)滴定法(EPA方法 9252)15
标准
氯化铁(FeCl3)的质量分数/% ≥ | 96.0 | 41.0 | 93.0 | 38.0 |
氯化亚铁(FeCl2)的质量分数/% ≤ | 2.0 | 0.30 | 3.5 | 0.40 |
不容物的质量分数 ≤ | 1.5 | 0.50 | 3.0 | 0.50 |
游离酸(以HCl计)的质量分数/% ≤ | — | 0.40 | — | 0.50 |
砷(As)的质量分数/% ≤ | 0.0004 | 0.0002 | — | — |
铅(Pb)的质量分数/% ≤ | 0.002 | 0.001 | — | — |
汞(Hg) 的质量分数/% ≤ | 0.00002 | 0.00001 | — | — |
镉(Cd)的质量分数/% ≤ | 0.0002 | 0.0001 | — | — |
铬[Cr(VI)]的质量分数/% ≤ | 0.001 | 0.0005 | — | — |
注意事项
泄露应急
隔离泄漏污染区,周围设警告标志,建议应急处理人员戴好防毒面具,穿化学防护服。不要直接接触泄漏物,避免扬尘,收集运至废物处理场所处置。使其溶于a.水、b.酸、或c.氧化成水溶液状态,再加硫化物发生沉淀反应,然后废弃。也可以用大量水冲洗,
来源: 百度百科
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
