苯甲酸是一种芳香酸类有机化合物,也是最简单的芳香酸1,化学式为C7H6O2。最初由安息香胶制得,故称安息香酸,略微具有苯甲醛或安息香的气味。在常温 25ºC 左右时 PKa 值为 4.2,属于一元弱酸但是酸性要比脂肪酸强,具有稳定的化学结构,不易被氧化。18熔点122.13 ℃,沸点249.2 ℃,相对密度(15/4 ℃)1.2659。外观为白色针状或鳞片状结晶。100 ℃以上时会升华。微溶于冷水、己烷,溶于热水、乙醇、乙醚、氯仿、苯、二硫化碳和松节油等234。
苯甲酸以游离酸、酯或其衍生物的形式广泛存在于自然界中。苯甲酸是一种重要的化工原料及化学反应中间体,主要用于制备苯甲酸钠防腐剂,并用于合成药物、染料,还用于制增塑剂、媒染剂、杀菌剂和香料等。苯甲酸的化学结构具有羧基和苯环,既能发生中和、成盐、成酯等反应,苯环上也可以发生间位取代反应,这使苯甲酸能够派生出很多衍生物。182
研究简史
苯甲酸是法国人在1618年首先发现的。20
19世纪50~70年代,从苯甲酰氨基乙酸中提取了生产药品所需的少量苯甲酸。
19世纪70年代,从邻苯二甲酸与氢氧化钙加热生产的邻苯二甲酸钙盐中回收苯甲酸。
19世纪90年代,用苯次甲基三氯水解法生产苯甲酸。第一次世界大战后出现了一些新的生产方法,其中邻苯二甲酸酐,邻苯二甲酸气相或液相脱羧生产苯甲酸是主要的生产方法。第二次世界大战后,甲苯液相空气氧化法迅速发展起来,逐渐成为生产苯甲酸的主要方法。
20世纪中期开始以工业规模生产苯甲酸。首先用甲苯液相空气氧化法生产苯甲酸的是美国联合(Allied)化学公司。
1961~1964年美国陶氏(Dow)化学公司、Amoeo化学品公司和意大利SNIA粘胶公司先后建厂投产,除Amoco化学品公司用钴盐和锰盐及少量溴化物作催化剂外,其余公司都只用钴盐和锰盐作催化剂。苏联一直采用邻苯二甲酸酐脱羧法生产苯甲酸,直到1977年才开始以甲苯液相空气氧化法生产苯甲酸。
在70年代中国已主要以甲苯液相空气氧化法生产苯甲酸。70年代末期正在进行甲苯气相空气氧化制苯甲酸,苯甲醛空气氧化制苯甲酸,甲苯液相或气相空气氧化制苯甲醛与苯甲酸的研究,但未见工业化报道。近年来各国只是在催化剂的组成(有Co一Mn一Br、Co—Mn—Li、Co—Mn一Pb、Co一Zn一Br、Mn一Ni一Br及V等体系)、副产物的回收利用和产品精制等方面对甲苯液相空气氧化法进行一些改进。
20世纪60年代以来,由于开发了用苯甲酸生产苯酚、对苯二甲酸和己内酰胺的方法,苯甲酸的产量才快速增长。5
理化性质
物理性质
苯甲酸是有光泽的、白色的、单斜品薄片状或针状结晶。质轻,无气味或微有类似安息香或苯甲醛的气味。它的蒸气有很强的刺激性,吸入后易引起咳嗽。能随水蒸气挥发。在约100 ℃时开始升华。7
1 g苯甲酸溶于2.3 mL冷乙醇、1.5 mL沸乙醇、4.5 mL氯仿、3 mL乙醚、3 mL丙酮、30 mL四氯化碳、10 mL苯、30 mL二硫化碳、23 mL松节油。水中溶解度随碱性物质(如硼砂、磷酸三钠)的存在而增加。
苯甲酸的常用物理性质数据如下表所示7:
项目 | 数值 | |
升华温度(℃) | 100 | |
折射率 | 15 ℃ | 1.53974 |
131.9 ℃ | 1.504 | |
临界常数 | 温度(℃) | 479 |
压力(kPa) | 4468.4 | |
密度(g/cm3) | 0.358 | |
压缩因子 | 0.244 | |
偏心因子 | 0.62 | |
离解常数25 ℃(Ka) | 6.339X10-57 | |
液体密度(g/cm3) | 130 ℃ | 1.078 |
160 ℃ | 1.049 | |
190 ℃ | 1.019 | |
220 ℃ | 0.9873 | |
蒸气压(kPa) | 96.0 ℃ | 0.1 |
146.7 ℃ | 2.7 | |
186.2 ℃ | 13.3 | |
249.2 ℃ | 101.3 | |
摩尔热容[J/(mol·℃)] | 180 ℃ | 232.95 |
210 ℃ | 240.91 | |
240 ℃ | 248.99 | |
270 ℃ | 257.32 | |
蒸发潜热(J/mol) | 130 ℃ | 59323 |
160 ℃ | 57355 | |
190 ℃ | 55270 | |
220 ℃ | 53043 | |
在水中溶解度(g/100g水) | 0 ℃ | 0.17 |
25 ℃ | 0.34 | |
50 ℃ | 0.85 | |
80 ℃ | 2.75 | |
其他溶剂中溶解度25 ℃(g/100g溶剂) | 无水乙醇 | 58.4 |
乙醚 | 40.8 | |
氯仿 | 15.02 | |
甲苯 | 10.6 | |
甲醇(23 ℃) | 71.5 | |
四氯化碳 | 4.14 | |
丙酮 | 55.6 | |
苯 | 12.17 | |
乙烷(17 ℃) | 0.94 | |
气体粘度(mPa·s) | 400 K | 86.78x10-4 |
600 K | 129.44x10-4 | |
800 K | 170.19x10-4 | |
液体粘度(mPa·s) | 130 ℃ | 1.29 |
160 ℃ | 0.9 | |
190 ℃ | 0.659 | |
化学性质
苯甲酸是苯环上的一个氢被羧基(—COOH)取代形成的化合物。苯甲酸的羰基与苯环平面分别成15°时,原子(基团)的空间作用能最低,成优势构象,间位具有较高电荷密度,在亲电取代反应中羰基(—COR)为间位定位基。6
甲酸在常温常压下性质稳定,不易发生反应。其化学性质主要取决于官能团的活性,即苯环和羧基。羧基上的反应包括与碱反应生成盐,与醇反应生成相应的酯,羟基被氯取代生成苯甲酰氯,被氨基取代生成苯甲酰胺等。苯甲酸中的苯环上的氢原子可以被各种原子或基团取代,但由于苯环上的羧基是能使苯环钝化的间位定位吸电子基,因此苯甲酸的磺化、硝化和氯化等取代反应要难于苯苯环上也可以进行加氢反应,苯甲酸在Pt作催化剂的情况下氧化生成六氢苯甲酸,它是生产己内酰胺的中间体。在高温下苯甲酸也能发生脱羧反应生成苯和二氧化碳。19
在羧基上的反应
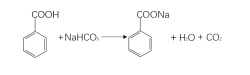
(1)转变成盐
苯甲酸在水中电离常数Ka=6.4×10-5(25 ℃),苯甲酸的酸性稍强于环己烷甲酸,这是由于苯环上的sp2杂化碳原子电负性较大,给电子作用较弱。可以与碱或者碱性物质反应。721
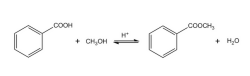
(2)转变成酯
苯甲酸与醇(如甲醇、丁醇、苄醇等)反应,生成相应的酯。例如7:
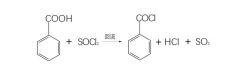
(3)转变成酰氯
苯甲酸中的羟基被氯取代生成苯甲酰氯[98-88-4],用于这个反应的含氯试剂有五氯化磷、三氯化磷和亚硫酰氯。例如7:
(4)转变成酸酐
苯甲酸与脱水剂一起加热时,两分子苯甲酸脱去一分子水生成苯甲酸酐[93-97-0]。常用乙酸酐作脱水剂,磷酸作催化剂。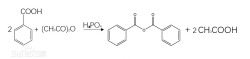
(5)转变成酰胺
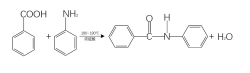
苯甲酸与苯胺在180~190 ℃的温度下反应,生成苯甲酰苯胺(N-苯甲酰替苯胺),该反应的产率约为84%。
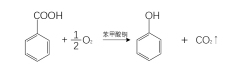
(6)氧化反应
用苯甲酸的铜盐作催化剂,用氧气氧化苯甲酸,可生成苯酚和二氧化碳。7
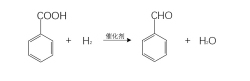
(7)还原反应
在Al(NO3)和Mn(NO3)2配制的催化剂下,苯甲酸可以和氢催化还原得到苯甲醛。8
在苯环上的取代反应
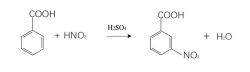
苯甲酸在苯环上发生亲电取代反应,苯环上的氢原子和苯的氢原子一样,可被各种原子或原子团取代,但苯甲酸苯环上的段基是吸电子基,是使苯环钝化的间位定位基,因此苯甲酸的磺化、硝化和氯化等取代反应比苯的相应反应要困难一些,使用催化剂和提高反应温度,可以克服这种钝化趋势。7
在苯环上的加氢反应
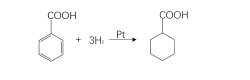
在金属铂作催化剂的情况下,苯甲酸氢化生成六氢苯甲酸,它是生产己内酰胺的中间体。添加水可使还原速度增快,反应温度和压力应比羧基还原时低。7
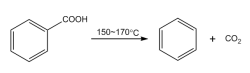
脱羧反应
苯甲酸可以在加热条件下,脱去羧基并生成二氧化碳,即发生脱羧反应(属于取代反应),反应温度约为150~170 ℃。
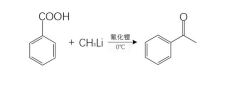
与金属有机化合物的反应
苯甲酸可以与格林试剂、甲基锂等金属有机化合物发生反应,生成对应的金属有机化合物。其中,苯甲酸与甲基锂反应是制备酮的一般方法。
制备方法
工业制备
最初苯甲酸是由安息香胶干馏或碱水水解制得,也可由马尿酸水解制得。工业上常用甲苯、邻二甲苯或萘为原料制备苯甲酸,上述原料可从煤焦油或石油中获得。此外,由甲苯生产苯甲醛时可副产苯甲酸。9苯甲酸的工业生产方法主要有甲苯液相空气氧化法、三氯甲苯水解法、邻苯二甲酸酐脱羧法,此外还有苄卤氧化法。10
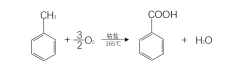
甲苯液相空气氧化法
最早用此法生产苯甲酸的是美国Alied公司。常用的催化剂为可溶性钴盐或锰盐,以乙酸为溶剂。其反应机理为自由基反应,反应温度为165 ℃左右,压力为0.6~0.8 MPa,反应为放热反应。副产物主要有苯甲醛、苯甲醇、邻甲基联苯、联苯、对甲基联苯及酯类。副产物均可回收和利用,尤其是苯甲醛和苯甲醇,其本身单价常为苯甲酸的4~5倍,可以大幅度提高装置的产值和利润。
尽管以甲苯为原料制苯甲酸的氧化法世界上还有气相氧化法、化学计量氧化法。甲苯的气相氧化需要在固定床或流化床反应器中进行,且应用的催化剂也较为复杂,一般需要主催化剂,助催化剂以及催化剂载体,另外需要加入添加剂才能使反应顺利进行。而且甲苯气相氧化需要高于350 ºC 的高温,反应条件严格,产生的杂质较多,反应中苯甲酸选择性低,实现工业化困难。甲苯液相氧化生产工艺简单,催化剂制备较为简便,一般不需要助剂,常用的催化剂有杂多化合物、金属卟啉化合物、非金属催化剂等。甲苯液相氧化的基本路径一般是由甲苯到苯甲酸的逐级氧化,应用不同催化剂实现甲苯的定向氧化。18 甲苯液相空气氧化反应条件温和,生产工艺简单,生产环境友好,具有生产成本低、收率高、安全性好等优点,是工业上生产苯甲酸的主要方法。整个生产过程由反应、产品精制、三废治理三个部分组成。19
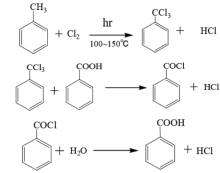
三氯甲苯水解法
甲苯于100~150 ℃进行光氯化反应所得三氯苄基苯,在ZnCl2存在下(或用石灰乳及铁粉)与水反应得苯甲酸。以三氯苄基苯计,苯甲酸产率为74%~80%。由于该法耗氯,HCl水溶液加热腐蚀极严重。因此,此法只能是甲苯氯化水解制苯甲醛和苯甲醇的副产物回收利用的补充方法。
在苄川三氯水解法生产苯甲酸的过程中,在甲苯氯化阶段会产生大量的氯化氢,使整个反应体系的酸度上升,对设备的腐蚀较严重。此外,该方法生产的苯甲酸纯度较低且含有氯,这限制了苯甲酸在食品,药品等行业的应用。18
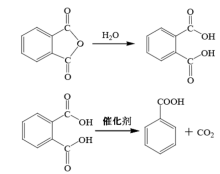
邻苯二甲酸酐脱羧法
该法分为液相法和气相法,其中液相法采用质量为邻苯二甲酸酐质量的2-6%的一种由等量邻苯二甲酸铬盐和邻苯二甲酸钠盐组成的混合物作为脱羧催化剂,该方法所得苯甲酸纯度较高,但产量低,不适合工业中大批量生产;气相法采用涂在粒状浮石上的等量碳酸铜和氢氧化钙作为催化剂,反应会产生邻苯二甲酸、少量联苯、二苯甲酮和蒽醌等副产物。181922
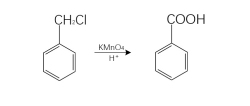
苄卤氧化法
以苄卤为原料,KMnO4作氧化剂也可制得苯甲酸。国内有文章报道用此法制苯甲酸,其后处理过程无需脱色和重结晶就能得到白色苯甲酸晶体,而且产率高达86%,反应是在有相转移催化剂存在下进行的。
上以上四种合成方法中,使用最广泛的是甲苯液相空气氧化法,全世界90%以上的苯甲酸仍是由此法合成;而邻苯二甲酸酐脱羧法制得的苯甲酸不易精制,并且成本高,只是在用量不大的医药产品制造过程中采用;甲苯氯化水解法耗氯,对管道的腐蚀极为严重,制得的产品不宜用于食品工业。19
实验室制备
原理:甲苯的甲基被酸性高锰酸钾溶液氧化成羧酸,生成苯甲酸,钾盐(K2SO4)、锰盐(MnSO4)和水。
方程式如下:
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 