碳(Carbon)是一种非金属元素,化学符号为C,在常温下具有稳定性,不易反应、极低的对人体的毒性,甚至可以以石墨或活性炭的形式安全地摄取,位于元素周期表的第二周期IVA族。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳和生物之中。拉丁语为Carbonium,意为“煤,木炭”。碳元素结构多样,能够以具有多方面性质的单质形式存在,如晶形碳、无定形碳和过渡碳。
碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳还有多种同素异形体,如金刚石、石墨、石墨烯、富勒烯等,这些同素异形体广泛应用于航空、医疗、石油化工、国防等领域。 碳能在化学上互相结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内绝大多数分子都含有碳元素。
发现历史
碳的英文名称carbon来源于拉丁文中煤和木炭的名称carbo,也来源于法语中的charbon,意思是木炭。在德国、荷兰和丹麦,碳的名字分别是Kohlenstoff、koolstof、kulstof,字面意思是煤物质。1
碳在史前就已被发现,炭黑和煤是人类最早使用碳的形式。大约公元前2500年中国就已经发现了钻石2,在罗马时代人们常使用碳的另一种形式—煤。3在1722年,法国人René Antoine Ferchault de Réaumur证明铁通过吸收一些物质能变成钢,这种物质就是碳。4在1772年,法国人安东尼·拉瓦锡当他将一些钻石和煤的样品燃烧时,发现他们都不生成水,并且每克的钻石和煤所产生的二氧化碳的量是相等的,表明钻石是碳的一种存在形式。在1779年,瑞典人卡尔·威廉·舍勒表明一度被认为是铅的石墨实质上是混杂了少量铁的碳混合物5,并且他将硝酸与石墨反应的产物命名为“空气中的酸”("aerial acid"),即二氧化碳。6在1786年,法国化学家Claude Louis Berthollet,GaspardMonge和C. A. Vandermonde通过拉瓦锡处理钻石的方法将石墨氧化,证明了石墨几乎全部由碳组成。71789年,拉瓦锡在他的教科书中将碳列在元素表中。6
存在分布
矿藏形式
碳既以游离元素存在(金刚石、石墨等),又以化合物形式存在(主要为钙、镁以及其他电正性元素的碳酸盐)。它的氧化物二氧化碳是大气中少量但极其重要的组分。预计碳在地壳岩石中的总丰度变化范围相当大,但典型的数值可取180ppm;按丰度顺序,这个元素位于第17位,在钡、锶、硫之后,锆、钒、氯、铬之前。89石墨遍布全球,然而大多数几乎没有价值。大量的晶体或薄片存在于变性的沉积硅酸盐岩石中,如石英、云母、片岩和片麻岩;晶体大小从不足1mm到6mm左右(平均4mm)。它沉积微扁豆状矿体,可达30m厚,横越田野,绵延数公里。平均含碳量达25%,但高的可达60%(马尔加什)。选矿是利用氢氟酸和盐酸处理后进行浮选,再在真空中加热到1500℃。微晶石墨(有时称为“无定形体”)存在于富碳的变性沉淀中,某些墨西哥的沉积物含有高达95%的碳。8
金刚石出自古代火山的筒状火成砾岩(火山筒),它嵌在一种比较柔软的、暗色的碱性岩石中,称为“蓝土”或“含钻石的火成岩”,1870年在南非的吉姆伯利城,首次发现这样的火山筒。10随着地质年代的变迁,火山筒逐渐风化腐蚀,在冲刷砂砾中和海滩上也能找到金刚石。8
焦炭、炭黑和活性炭这三种其他形式的碳被大规模制造并广泛运用于工业。8
自然界中的循环
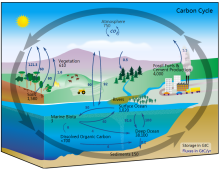 碳在自然界中的流动构成了碳循环。例如,植物通过碳呼吸和卡尔文循环(一种碳固定的过程)等方式从环境中吸收二氧化碳用来储存生物质能,生物质能通过捕食而转移,同时碳也可以以二氧化碳的形式被动物呼出,如下图所示。碳循环的实际结构要比下图的模式图复杂得多,例如,一些二氧化碳会溶解在海洋中,死去的植物或动物的遗骸可能会形成煤、石油和天然气,这些可以通过燃烧释放碳,而细菌则无法利用。11
碳在自然界中的流动构成了碳循环。例如,植物通过碳呼吸和卡尔文循环(一种碳固定的过程)等方式从环境中吸收二氧化碳用来储存生物质能,生物质能通过捕食而转移,同时碳也可以以二氧化碳的形式被动物呼出,如下图所示。碳循环的实际结构要比下图的模式图复杂得多,例如,一些二氧化碳会溶解在海洋中,死去的植物或动物的遗骸可能会形成煤、石油和天然气,这些可以通过燃烧释放碳,而细菌则无法利用。11
恒星中的形成
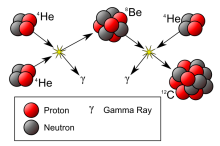 碳原子核的形成需要α粒子(氦核)在巨核或超巨星中发生几乎同时的三重碰撞,这个过程称为三氦过程。这种核融合反应可以在超过一亿度K的高温和氦含量丰富的恒星内部迅速的发生。同样的,他发生在较老年,经由质子-质子链反应和碳氮氧循环产生的氦,累积在核心的恒星。在核心的氢已经燃烧完后,核心将塌缩,直到温度达到氦燃烧的燃点。反应的过程是:
碳原子核的形成需要α粒子(氦核)在巨核或超巨星中发生几乎同时的三重碰撞,这个过程称为三氦过程。这种核融合反应可以在超过一亿度K的高温和氦含量丰富的恒星内部迅速的发生。同样的,他发生在较老年,经由质子-质子链反应和碳氮氧循环产生的氦,累积在核心的恒星。在核心的氢已经燃烧完后,核心将塌缩,直到温度达到氦燃烧的燃点。反应的过程是:
4He+4He→8Be (−93.7 keV)
8Be+4He→12C (+7.367 MeV)
反应过程的净能量释放为1.166pJ。
另一个为恒星供能的融合机制是CNO循环(碳-氮-氧循环,有时也称为贝斯-魏茨泽克-循环,是恒星将氢转换成氦的两种过程之一,另一种过程是质子-质子链反应),其中碳作为催化剂使得反应能够进行。
同位素
现代已知的同位素共有十五种,有碳8至碳22,其中碳12和碳13属于稳定型,其余的均带放射性,当中碳14的半衰期长达5730年,其他的为不稳定同位素。 在自然界里,碳12在碳总量中占比高达98.93%,碳13则只有1.07%。C的原子量取碳12、13两种同位素丰度加权的平均值,一般计算时取12.01。碳12是国际单位制中定义摩尔的尺度,以12克碳12中含有的原子数为1摩尔。由于碳14具有较长的半衰期,人们可通过测定一件古物的碳14含量,来估计它的大概年龄,这种方法称之为碳定年法。9
|| || 不同碳同位素的性质
同素异形体
碳的同素异形体主要分为晶形碳、无定形碳、过渡碳等3大类,不同形态的碳单质物理性质不相同。12
晶形碳
晶形碳主要有石墨、金刚石、富勒烯、石墨烯、碳纳米管等。其中金刚石具有典型的共价晶体特性,即高的硬度、高的熔点和低的等电性和低的导热性;石墨烯具有良好的机械性能、导电性能以及导热性能13。14
无定形碳
无定形碳包括木炭、活性炭、碳纤维等。其中活性炭是一种具有特殊微晶结构、发达孔隙结构、巨大比表面积和较强吸附能力的同素异形体。其化学稳定性好,具有耐酸、耐碱、耐高温等特点,活性炭不溶于水和有机溶剂,既可在气相中使用,也可以在液相中使用。可以通过对活性炭进行酸碱处理改变活性炭的性质,得到的活性炭又称改性活性炭15。碳纤维是一种含碳量在95%以上的碳的同素异形体,既有碳材料的质轻、耐高温、耐腐蚀、耐疲劳、抗蠕变、高强度、高模量等固有本征特性,又有纺织纤维的柔软可加工性16。
过渡碳
过渡碳为无定形碳过渡到晶形碳的过程中产生的中间产物,兼具了无定形碳和晶形碳的一些特点,表现出乱层石墨结构的特征,在微观上呈现出二维有序而三维无序的特点17。
过渡碳主要是热解炭黑。其中热解炭黑根据微观结构的不同可大致分为各向异性和各向同性两大类:各向同性热解炭结构均匀致密,抗氧化性能好;各向异性热解炭结构致密、晶粒尺寸小、性能结构均一,与传统炭质材料相比,在强度、耐磨、润滑、密封等方面的性能表现更加优良17。
物质结构
碳的杂化轨道理论碳原子的基态电子构型为1s22s22p2,根据该构型,碳的价态应该表现为2价,但在大量有机分子中碳的价态是4价,这是因为在外界干扰下,若干能量相近的原子轨道可以组合成同样数目的、能量完全相同的新的原子轨道,这种新的轨道就称为杂化轨道。这就解释了多原子分子的空间构型和用普通价键理论所不能解释的某些共价分子的形成方式。并且,碳原子除了 sp,sp2,sp3等多种轨道杂化形式以外,还可以形成某些中间过渡状态的杂化态,从而使碳有不同的过渡态结构存在18。
化学性质
单质
|| || 碳单质的化学性质
化合物
碳的化合物中,只有以下化合物属于无机物:碳的氧化物、碳化物、碳的硫属化合物、二硫化碳(CS2)、碳酸盐、碳酸氢盐、氰及一系列拟卤素及其拟卤化物、拟卤酸盐,如氰[(CN)2]、氧氰[(OCN)2],硫氰[(SCN)2],其它含碳化合物都是有机化合物。
由于碳原子形成的键都比较稳定,有机化合物中碳的个数、排列以及取代基的种类、位置都具有高度的随意性,因此造成了有机物数量极其繁多这一现象,现代人类发现的化合物中有机物占绝大多数。有机物的性质与无机物大不相同,它们一般可燃、不易溶于水,反应机理复杂,已形成一门独立的分科——有机化学。
毒理性质
纯碳对人体的毒性极低,石墨或活性炭甚至可以被人体摄取。碳一般不溶且不易被化学侵蚀,即使面对的是消化道内的酸性物质,因此它一旦进入人体组织后可能会无期限存留。炭黑可能是最早用来纹身的颜料之一,如冰人奥兹被发现有炭黑纹身,这些纹身从他存活开始一直到他死后5200年后都一直存在。19然而,吸入大量煤炭(或炭黑)粉尘或烟尘是危险的,它们会刺激肺组织,并引起充血性肺病煤工尘肺。相似的,金刚石磨粉被误食或吸入也会有危险。
碳对地球上几乎所有生物来说都是低毒的,然而对某些生物是有毒的,例如碳纳米颗粒对果蝇是致命的。
来源: 百度百科
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
