氨气(英文名Ammonia),是一种无机化合物,化学式为NH3,分子量为17.031。标准状况下密度为0.771 g/L,相对密度0.5971(空气=1.00)。是一种无色、有强烈的刺激气味的气体。氨气能使湿润的红色石蕊试纸变蓝,能在水中产生少量氢氧根离子,呈弱碱性。在常温下加压即可使其液化,沸点-33.5℃,也易被固化成雪状固体,熔点-77.75℃,溶于水、乙醇和乙醚。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时氨气可被氧化成一氧化氮。氨气常用于制液氮、氨水、硝酸、铵盐和胺类等。氨气可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜,人吸入过多,能引起肺肿胀,以至死亡。12
氨气被列入《危险化学品名录》,9并按照《危险化学品安全管理条例》管控。10
研究简史
自古以来,人们就知道氨的气味。18世纪,著名化学家约瑟夫·布莱克(苏格兰)、彼得·沃尔夫(爱尔兰)、卡尔·威廉·舍勒(瑞典/德国)和约瑟夫·普里斯特利(英格兰)发现空气中的氮能被碳化钙固定而生成氰氨化钙,氰氨化钙与过热水蒸汽反应制的氨。1785年,法国化学家克劳德·路易斯·贝索莱测定了它的元素组成。
由于氮气的化学性质很不活泼,以氮气和氢气为原料合成氨的工业化生产曾是一个较难的课题。1909年,德国化学家哈伯(E.Haber,1868-1934)经过反复的实验研究后发现,在500-600℃、17.5~20.0 MPa和锇为催化剂的条件下,反应后氨的含量可达到6%以上,具备了工业化生产的可能性。为了把哈伯合成氨的实验室方法转化为规模化的工业生产,德国工程师博施(C. Bosch,1874-1940)改进了哈伯首创的高压合成氨,找到了合适的氧化铁型催化剂,使合成氨生产工业化,称为"哈伯--博施法"。
1913年,一个年产量7000吨的合成氨工厂建成并投产,实现了合成氨的工业化生产。从此,合成氨成为化学工业中迅速发展的重要领域。由于合成氨工业生产的实现和相关研究对化学理论与技术发展的推动,哈伯和博施都获得了诺贝尔化学奖。合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。3
2020年,全球氨生产能力为2.24亿吨。实际产量为1.87亿吨,在全球生产的化学品中排名第九。
来源
氨是自然界中常见的气体之一,它存在于空气中、水中和土壤中,同时也是植物和动物体内重要的氮源。其中最主要的是来自动物排泄物和植物腐殖质,还有一部分来自养殖和农业等人类活动。这些氨来自蛋白质分解后产生的氨基酸、尿素和其他含氮有机物。此外,大气中的雷电、火山、野火等也会产生氨。氨进入大气后会随着空气流动和降雨逐渐沉降,从而成为土壤中的氮源,然而如果过量存在,可能会影响大气质量和生态系统健康。4
体内代谢
体内氨主要由组织内氨基酸的分解、肾脏细胞内氨基酸的分解以及肠道内尿素水解和腐败作用产生。氨是有毒的物质,人体必须及时将氨转变成无毒或毒性小的物质,然后排出体外。主要去路是在肝脏合成尿素、随尿排出;一部分氨可以合成谷氨酰胺和门冬酰胺,也可合成其它非必需氨基酸;少量的氨可直接经尿排出体外。5
分子结构
氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子。
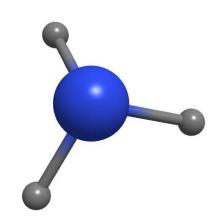 从氨的结构来看,氨分子里的氮原子还有一个孤对电子,可以结合成质子,显示碱性;可作为Lewis碱,形成配位化合物(如加合物);氨分子上有三个活性氢,可以被取代而发生取代反应;氨分子的空间结构是三角锥形,极性分子。6
从氨的结构来看,氨分子里的氮原子还有一个孤对电子,可以结合成质子,显示碱性;可作为Lewis碱,形成配位化合物(如加合物);氨分子上有三个活性氢,可以被取代而发生取代反应;氨分子的空间结构是三角锥形,极性分子。6
理化性质
物理性质
氨气在标准状况下的密度 | 0.771g/L |
|---|---|
临界点 | 132.4℃ |
蒸汽压 | 506.62 kPa(4.7℃) |
熔点 | -77.7℃ (常压) |
沸点 | -33.5℃ (常压) |
溶解性 | 极易溶于水(体积:1:700或质量:53.97 g/100 g) |
自燃点 | 651.1℃ |
临界压力 | 11.2MPa |
临界体积 | 72.47cm3/mol |
临界密度 | 0.235g/cm3 |
临界压缩系数 | 0.242 |
液体热膨胀系数 | 25℃时0.00251/℃ |
表面张力 | 19.75×10-3N/m,19.75dyn/cm |
汽化热 | 1336.97kJ/kg,574.9BTU/1b |
熔化热 | 332.16kJ/kg,142.83BTU/1b |
气体定压比热容 | 2.112kJ/(kg·K),0.505BTU/(1b·R) |
气体定容比热容 | 1.624kJ/(kg·K),0.388BTU/(1b·R) |
气体比热容比 | 1.301 |
气体摩尔熵 | 192.67J/(mol·K) |
气体摩尔生成焓 | -45.9kJ/mol |
气体黏度 | 101.15×10-7Pa·s,101.15μPa |
液体黏度 | 0.135mPa·s |
燃烧热 | 25℃(77 ℉)气态时18603.1kJ/kg,7999.3BTU/1 b |
空气中爆炸低限含量 | 16.1% |
空气中爆炸高限含量 | 25%1 |
氨在室温下于0.6~0.7MPa时可液化(临界温度为132.5℃,临界压力为11.23MPa)。氨极易溶于水,也溶于乙醇。液氨为无机质子性非水溶剂,有较大的介电常数、偶极矩和氢键键能。摩尔体积比水大,但比HCN、H2S、SO2等其他无机溶剂小,是一种自行离解小(pKa=34,-33℃)碱性强的溶剂。因此,液氨能很好地溶解强电解质。同时由于范德华力大,也能溶解碘离子、烯烃、芳香烃以及含有羟基和氨基的化合物。液氨最特殊的性质是能溶解碱金属和碱土金属,作为化学还原的溶剂用于多种有机化学反应。1
化学性质
1.与水反应
在常温,常压下,一体积的水中能溶解700体积的氨。
氨在水中的反应可生成一水合氨:
![]()
一水合氨不稳定受热分解生成氨和水:
![]()
喷泉实验:
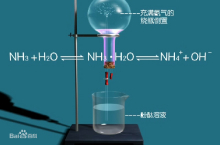 在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛水的烧杯里(水里事先加入少量的酚酞试液),把实验装置装好后。打开橡皮管的夹子,挤压滴管的胶头,使少量的水进入烧瓶,可以观察到酚酞溶液变红并且在尖嘴导管口形成喷泉。
在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛水的烧杯里(水里事先加入少量的酚酞试液),把实验装置装好后。打开橡皮管的夹子,挤压滴管的胶头,使少量的水进入烧瓶,可以观察到酚酞溶液变红并且在尖嘴导管口形成喷泉。
实验的基本原理是加水使烧瓶内大部分氨气溶于水,在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,从而在导管口形成喷泉。3
2.与酸反应
铵氨与酸作用可得到铵盐,铵盐是由铵根离子![]() 和酸根离子组成的化合物。一般为无色晶体,易溶于水,是强电解质。从结构来看,
和酸根离子组成的化合物。一般为无色晶体,易溶于水,是强电解质。从结构来看,![]() 和
和![]() 是广义等电子体。
是广义等电子体。![]() 的半径比
的半径比![]() 的大,而且接近于
的大,而且接近于![]() ,因此
,因此![]() 具有+1价碱金属离子的性质,在晶体结构和溶解度方面非常相似,除酒石酸氢铵等外大多数铵盐都溶于水。但由于
具有+1价碱金属离子的性质,在晶体结构和溶解度方面非常相似,除酒石酸氢铵等外大多数铵盐都溶于水。但由于![]() 是由5个原子组成的,与一般碱金属离子性质也有所差别(如易分解性·,水解性,热稳定性差)。6
是由5个原子组成的,与一般碱金属离子性质也有所差别(如易分解性·,水解性,热稳定性差)。6
反应对象 | 反应方程式 |
|---|---|
氨与硝酸 | NH3+HNO3=NH4NO3 |
氨与硫酸 | 2NH3+H2SO4=(NH4)2SO4 |
氨与盐酸 | NH3+HCl=NH4Cl |
氨与磷酸 | 3NH3+H3PO4=(NH4)3PO4 |
氨与乙酸 | NH3+CH3COOH=CH3COONH4 |
氨与碳酸 | NH3+H2CO3=NH4HCO3 |
碳酸氢铵不稳定受热分解 |
|
3.氧化还原反应
氨分子中的N原子的氧化数为-3,为氮的最低氧化态,在一定条件下可以被氧化形成较高氧化数的物质,产物中以N2为主。如,在热的铂丝催化下与氧气反应、在纯氧中燃烧、用氯或溴处理,都可将其氧化:
![]()
![]()
![]()
![]()
![]()
另外,氨气还能将金属氧化物还原为金属单质,如在加热条件下氨气会与氧化铜发生反应:6
![]()
氨在空气中燃烧产生绿色火焰,若点燃氨与空气的混合物(体积比在16%~25%时)可以发生爆炸。1
4.加合反应
加合反应(氨合反应):作为Lewis碱,氨以其分子中的孤对电子与许多金属离子(路易斯酸)作用形成氨配离子,如[Ag(NH3)2]+、[Cu(NH3)4]2+、[Cr(NH3)6]3+、[Co(NH3)6]3+和[Pt(NH3)4]2+等,使许多难溶化合物溶解。
![]()
![]()
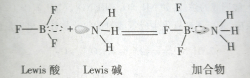 此外,氨还可与具有空轨道的Lewis酸直接作用形成相应的加合物,如:6
此外,氨还可与具有空轨道的Lewis酸直接作用形成相应的加合物,如:6
5.取代反应
取代反应(又称氨解反应):从两方面考虑,把NH3当作三元酸,其氢原子可依次被取代分别生成氨基、亚氨基和氮化物的衍生物,取代氢的基团可为金属、非金属或其他基团
![]()
![]()
![]()
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
