乙醛(acetaldehyde),又名醋醛,化学式为CH3CHO,属醛酮类有机化合物,为无色透明、有刺激性气味、易挥发、易燃的液体,易溶于水,能以任意比例与乙醇、乙醚、苯、汽油、甲苯等有机溶剂混溶16,被广泛用作有机合成醋酸、醋酐、丁醇、多聚乙醛、合成橡胶等产品的原料、消毒剂、炸药、还原剂,亦可用于制备通过比色法测定醛的标准溶液1。
乙醛的工业化生产有乙烯直接氧化、乙醇氧化、乙炔直接水合、乙醇脱氢以及乙酸加氢等方法,其下游产品包括吡啶、巴豆醛、山梨酸等。
2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,乙醛在2B类致癌物清单中13。
历史背景
.
(1)1774年,瑞典无机化学家、氧气的发现者之一的卡尔·威尔海姆·舍勒(Carl Wilhelm Scheele,1742-1786)发现乙醇脱氢可制取乙醛17;
(2)1881年,俄国化学家Mikhail Kucherov指出18,在溴化汞(HgBr2)作为催化剂时,乙炔水合的主产物是乙醛,而其他炔烃发生水合反应则生成酮类物质,这为乙醛的产业化开辟了新道路;
(3)1916年,德国建成了首个乙醛生产工厂;
(4)1953年,上海试剂一厂建成一套乙醇-乙醛-醋酸路线工业生产装置;
(5)20世纪80年代初,我国先后引进了4套乙烯-乙醛装置19;
(6)世界乙醛3大生产厂家是美国伊士曼化工公司、日本昭和电工公司和中油吉林石化公司,合计占2016年世界乙醛生产能力的23%,同年,我国乙醛生产能力为91.88万吨20。
理化性质
物理性质
乙醛在常温常压下为无色透明、有刺激性气味、易挥发、易燃的液体,根据相似相溶原理,乙醛不仅易溶于水,还能以任意比例与乙醇、乙醚、苯、汽油、甲苯等有机溶剂混溶,其某些物理性质如下表所示(源于Aspen Plus V14物性数据库)。
名称 | 单位 | 数值 |
熔点 | ℃ | -123.5 |
沸点 | ℃ | 20.8 |
闪点 | ℃ | -39(CC)、-40(OC) |
燃点 | ℃ | 175 |
相对密度(ρ水 = 1、16 ℃) | — | 0.788 |
相对蒸气密度(ρ空气= 1) | — | 1.52 |
燃烧热 | kJ/mol | -1166.37 |
临界温度 | ℃ | 188 |
临界压力 | MPa | 6.4 |
临界体积 | m³/kmol | 0.154 |
熔化热 | kJ/mol | 2.31 |
临界密度 | g/cm³ | 0.286 |
临界压缩因子 | — | 0.221 |
Pitzer偏心因子 | — | 0.262 |
偶极矩 | D | 2.689 |
饱和蒸汽压(20 ℃) | kPa | 98.64 |
标准摩尔生成吉布斯函数 | kJ/mol | -128.86 |
标准摩尔生成焓 | kJ/mol | -166.19 |
标准摩尔熵 | kJ·kmol-1·K-1 | 250.3 |
25 ℃、100 kPa下的摩尔定压热容 | kJ·kmol-1·K-1 | 57.3 |
爆炸上、下限 | % | 57、4.0 |
辛醇/水分配系数 | — | 0.43 |
标准API重度 | ° | 48.9 |
此外,乙醛气体的摩尔定压热容随温度在298~1500 K范围内的变化关系可用关于温度的二次函数表示21。
Cp,m = a + bT + cT2
注:系数a、b、c分别为31.05、121.46、-36.58,量纲分别为kJ·kmol-1·K-1、10-3kJ·kmol-1·K-2、10-6kJ·kmol-1·K-3。
化学性质
(1)sp2杂化
醛、酮的结构均含有碳氧双键(-C=O、羰基),碳原子以三个sp2杂化轨道,分别与氧原子和另外两个原子形成三个位于同一个平面的σ键,键角近似于120°,羰基碳剩下的一个未参与杂化的p轨道与氧原子的一个p轨道从侧面相互交盖形成一个π键,而氧原子的两个p轨道还有两对孤对电子。
以结构最简单的甲醛为例,碳氧双键、碳氢单键键长分别为120.3 pm和110 pm。
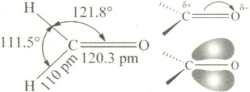
由于氧原子的电负性大于碳原子,因此碳氧双键中的电子云偏向于氧原子,使其周围的电子云密度较高,而碳原子的电子云密度较低,故羰基具有极性,乙醛是极性分子,这亦解释了乙醛易溶于极性溶剂的原因(相似相溶)。
(2)α-氢原子
① 弱酸性
醛、酮的α-氢原子非常活泼,主要原因有二,其一是羰基的的吸电子诱导效应;其二是α碳氢键对羰基的超共轭效应22。

以2-甲基环己酮为例,经同位素交换实验可证明羰基旁的α-氢原子具有较高的活性,在氘氧化纳(重氢氧化钠、NaOD)和重水(D2O)的作用下,均可被氘原子取代。
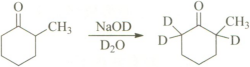
纵然不同羰基化合物的α-H活性不一,但醛类相较同系列的烷烃、炔烃和酮而言,具有更强的酸性。原因一方面是烷基的空间位阻大于氢原子,另一方面是烷基与羰基的超共轭效应会降低羰基碳的正电性23。
有机物 | CH3CHO | H3C-CO-CH3 | HC≡CH | H3C-CH3 |
pKa | 17 | 20 | 25 | 50 |
注:p代表负对数,pKa越小,酸性越强。
② 互变异构
一般地,大部分的醛、酮均存在互变异构体,以乙醛为例,存在酮式和烯醇式互变异构,由于烯醇式(enol form)结构不稳定,因此乙醛的酮式结构几乎占据100%,平衡常数约为6.0×10-5。
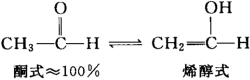
注:烯醇式结构不稳定的原因是,碳碳双键的存在使碳原子的π电子云的密度增加,但由于氧的电负性较强,因此,电子云又倾向于向氧原子靠拢,如此“矛盾”的结果导致烯醇式结构的不稳定。
③ 羟醛缩合
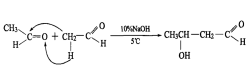
在稀碱溶液的作用下,乙醛分子间可在低温下发生羟醛缩合反应,即α-氢原子进攻羰基氧原子,其余基团与羰基碳原子结合,生成碳原子数扩大一倍的β-羟基丁醛。
(3)亲核加成
羰基结构中的碳原子带部分的正电荷,易受到亲核试剂的进攻,在酸碱环境下均可发生π键断裂的加成反应。
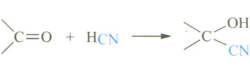
① 氢氰酸
氢氰酸是典型的亲核试剂,与乙醛反应可生成2-羟基丙腈(α-羟基腈),在碱性条件下的反应速率将大大加快,原因是HCN作为弱酸,在碱性条件下易生成氰负离子(CN-),从而增加反应物的浓度;反之,若在酸性条件下进行,氢离子与羰基产生质子化作用,增强羰基碳的亲电性,不利于反应的进行,反应速率将减慢。
HCN + NaOH → NaCN + H2O
CH3CHO + HCN → CH3-CH(OH)-CN

此外,2-羟基丙腈在酸性条件下水解可制取2-羟基丙酸(俗称“乳酸”),因此,氢氰酸的亲核加成反应可用于合成多一个碳原子的羟基酸。
CH3-CH(OH)-CN + 2H2O + H+ → CH3-CH(OH)-COOH + NH4+
② 亚硫酸氢钠
乙醛与过量的饱和亚硫酸氢钠溶液可在无需催化剂的情况下,经震荡引发亲核反应生成亚硫酸氢钠加成物。
CH3CHO + NaHSO3 → CH3-CH(OH)-SO3Na
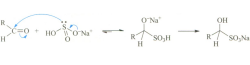
该亚硫酸氢钠加成物(α-羟基磺酸钠)易溶于水,难溶于有机溶剂,因此会从有机相扩散至水相形成晶体,故该反应可用于从不溶于水的有机物中分离醛。
注:α-羟基磺酸钠与氰化钠作用,磺酸基可被氰基取代生成α-羟基腈(腈醇),由此可避免剧毒且挥发性强的氢氰酸产生。
CH3-CH(OH)-SO3Na + NaCN → CH3-CH(OH)-CN + Na2SO3
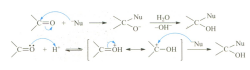
③ 格式试剂
乙醛可与格林尼亚(Grignard)试剂(俗称“格式试剂”,可简写为“RMgX”)在无水醚的 作用下反应,首先生成镁代化合物(中间产物),然后再酸性条件下水解可直接生成醇,该反应也是通过亲核加成反应合成醇的方式之一,类似的还有有机锂试剂。
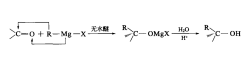
以环己烷为烃基的格式试剂与乙醛的反应为例。
CH3CHO + C6H11-MgX → H11C6-CH(OH)-CH3
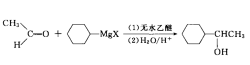
注:格式试剂是由法国科学家弗朗索瓦·奥古斯特·维克多·格林尼亚(Francois Auguste Victor Grignard,1871-1935)于1901年合成,是将有机卤素(氯、溴、碘)化合物(卤代烷、活泼卤代芳烃)与金属镁在干燥无水乙醚中反应形成的有机镁试剂。
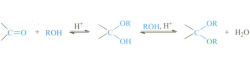
④ 醇
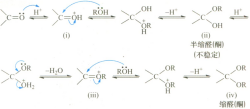
醇亦具有亲和性,在酸(如对甲苯磺酸和氯化氢)的催化下,可与乙醛发生亲核加成反应生成不稳定的半缩醛,再脱除一分子水生成缩醛。
具体的反应机理如下,首先羰基和氢离子产生质子化作用生成氧鎓离子(oxonium),羰基碳原子的亲电性增加;其次,与醇发生加成反应的同时失去质子,生成不稳定的半缩醛;随后,与H+结合为氧鎓离子脱水;最后,再与醇作用生成较为稳定的缩醛,总的结果是一分子的醛酮可与两分子的醇发生反应生成一分子的缩醛。
以甲醇为例,与乙醛反应可生成二甲氧基乙烷(缩醛)。
CH3CHO + 2CH3OH → (H3CO)2-CH-CH3 + H2O
⑤ 水
在酸性环境下,水可与乙醛发生亲核加成反应生成二羟基乙烷(偕二醇)。
CH3CHO + H2O → (HO)2-CH-CH3
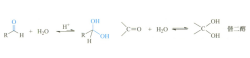
注:同一个碳原子连接两个羟基的分子结构缺乏热力学稳定性,有失水重新变为醛和酮的趋势,即水和羰基的加成反应是可逆反应,平衡偏向于反应物一侧。
⑥ 氨及胺的衍生物
所有的醛和酮均能与氨及胺的衍生物(如羟胺、肼、苯肼、氨基脲等)发生亲核加成反应,分别生成肟、腙、苯腙、缩胺脲等稳定产物,但与氨反应的产物不稳定。
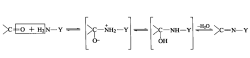
以2,4-二硝基苯肼为例,与乙醛反应、脱水生成2,4-二硝基苯腙的化学方程式如图所示。
来源: 百度百科
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
