共价键(covalent bond),是化学键的一种,两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定的化学结构,像这样由几个相邻原子通过共用电子并与共用电子之间形成的一种强烈作用叫做共价键。其本质是原子轨道重叠后,高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用。共价键通常发生在非金属原子之间,因为非金属原子倾向于接受或分享电子,以满足其价壳电子的规则。共价键的强度通常取决于原子间的电负性差异。电负性是一个原子吸引共享电子的能力的度量,电负性差异较小的原子倾向于形成较弱的共价键,而电负性差异较大的原子之间则形成较强的共价键。
历史
早期历史
 在古希腊,化学还没有从自然哲学中分离的时代,原子论者对化学键有了最原始的设想,恩培多克勒(Empedocles)认为,世界由“气、水、土、火”这四种元素组成,这四种元素在“爱”和“恨”的作用下分裂并以新的排列重新组合时,物质就发生了质的变化。这种作用力可以被看成是最早的化学键思想。
在古希腊,化学还没有从自然哲学中分离的时代,原子论者对化学键有了最原始的设想,恩培多克勒(Empedocles)认为,世界由“气、水、土、火”这四种元素组成,这四种元素在“爱”和“恨”的作用下分裂并以新的排列重新组合时,物质就发生了质的变化。这种作用力可以被看成是最早的化学键思想。
随后,原子论者德谟克利特设想,原子与原子间,存在着一种“钩子”,也可以说是粗糙的表面,以致它们在相互碰撞时黏在一起,构成了一个稳定的聚集体。德谟克利特对化学键的设想相比于之前的自然哲学家,是更加先进的,他剔除了此类设想中的唯心主义因素。
中世纪的J.R.格劳伯则提出了物质同类相亲、异类相斥的思想。其后还出现了关于物质结合的亲和力说,认为物质的微粒具有亲和力,由此互相吸引而结合在一起。总之,人们关于化学键朦胧的认识,启发了后来的化学家。
近代史
18世纪,燃素(phlogiston)的概念进入了化学,并为恩斯特·施塔尔(Ernst Stahl)、亨利·卡文迪许(Henry Cavendish)和约瑟夫·普利斯特里(Joseph Priestley)等先进的化学家所接受。当时,牛顿力学已经提出,他们希望把原子间的作用力和牛顿力学结合起来,给出经典物理学的解释,但限于当时的条件,这无疑是无法完成的。
1916年,德国化学家沃尔特·柯塞尔(Walther Kossel)在考察大量事实后得出结论:任何元素的原子都要使最外层满足8电子稳定结构,但科塞尔只解释了离子化合物的形成过程,并没有解释共价键的形成。1
1919年,化学家欧文·朗缪尔首次使用“共价”来描述原子间的成键过程2“(原文)we shall denote by the termcovalencethe number of pairs of electrons which a given atom shares with its neighbors”3(我们应该用“共价”一词表示原子间通过共用电子对形成的作用力)。
1922年,尼尔斯·玻尔(N.Bohr)从量子化的角度重新审视了卢瑟福的核式模型,这为化学家对化学键的认识,提供了全新的平台,他认为电子应该位于确定的轨道之中,并且能够在不同轨道之间跃迁,定态跃迁可以很好的解释氢原子光谱的各个谱线。4
 1923年,美国化学家吉尔伯特·路易斯(G.N.Lewis)发展了科塞尔的理论,提出共价键的电子对理论2。路易斯假设:在分子中来自于一个原子的一个电子与另一个原子的一个电子以“电子对”的形式形成原子间的化学键。这在当时是一个有悖于正统理论的假设,因为库仑定律表明,两个电子间是相互排斥的,但路易斯这种设想很快就为化学界所接受,并导致原子间电子自旋相反假设的提出。
1923年,美国化学家吉尔伯特·路易斯(G.N.Lewis)发展了科塞尔的理论,提出共价键的电子对理论2。路易斯假设:在分子中来自于一个原子的一个电子与另一个原子的一个电子以“电子对”的形式形成原子间的化学键。这在当时是一个有悖于正统理论的假设,因为库仑定律表明,两个电子间是相互排斥的,但路易斯这种设想很快就为化学界所接受,并导致原子间电子自旋相反假设的提出。
1924年,路易斯·德布罗意(Louis de Broglie)提出波粒二象性的假说,建立了一个原子的数学模型,用来将电子描述为一个三维波形。在数学上不能够同时得到位置和动量的精确值。
1926年,薛定谔提出量子力学的波动方程,它可以直接用来解释化学键的“形成”和“断裂”,这成为量子化学最初的开端。
1927年,沃尔特·海特勒(W.H.Heitler)和弗里茨·伦敦(F.London)用量子力学处理氢分子,用近似方法算出了氢分子体系的波函数,首次用量子力学方法解决共价键问题。价键理论在这一方法的推广中诞生,他们研究共价键的方法就被称为HL法。2
1928年,恩利克·费米(Enrica Fermi)提出了一个基于泊松分布的单电子密度模型试图解决原子结构问题。5之后,道格拉斯·哈特里(Douglas Rayner Hartree)运用迭代法,将体系电子的哈密顿算子分解为若干个单电子哈密顿算子的简单加和,进而将体系多电子波函数表示为单电子波函数的积,改进这一模型,提出哈特里方程6。
1930年,哈特里的学生福克(Fock)与约翰·斯莱特(John Clarke Slater)完善了哈特里方程,称为哈特里-福克方程(HF)。50年代初,斯莱特得到了HF的近似波函数:哈特里-福克-斯莱特方程(HFS)7。1963年,赫尔曼(F.Hermann)和斯基尔曼(S.Skillman)把HFS应用于基态原子函数8。
1950年,克莱蒙斯·罗瑟恩(C. C. J. Roothaan)进一步提出将方程中的分子轨道用组成分子的原子轨道线性展开,发展出了著名的RHF方程8,1964年,计算机化学家恩里克·克莱门蒂(E.Clementi)发表了大量的RHF波函数,该方程以及后续的改进版已经成为现代处理量子化学问题的主要方法。
 1929年,贝特等提出配位场理论,最先用于讨论过渡金属离子在晶体场中的能级分裂,后来又与分子轨道理论结合,发展成为现代的配位场理论。1930年,美国化学家莱纳斯·鲍林(L.C.Pauling)在研究碳的正四面体构形时提出轨道杂化理论,认为:能级相近的轨道在受激时可以发生杂化,形成新的简并轨道,其理论依据就是电子的波粒二象性,而波是可以叠加的。他计算出了多种杂化轨道的形状,并因在价键理论方面的突出贡献而获得诺贝尔化学奖。2
1929年,贝特等提出配位场理论,最先用于讨论过渡金属离子在晶体场中的能级分裂,后来又与分子轨道理论结合,发展成为现代的配位场理论。1930年,美国化学家莱纳斯·鲍林(L.C.Pauling)在研究碳的正四面体构形时提出轨道杂化理论,认为:能级相近的轨道在受激时可以发生杂化,形成新的简并轨道,其理论依据就是电子的波粒二象性,而波是可以叠加的。他计算出了多种杂化轨道的形状,并因在价键理论方面的突出贡献而获得诺贝尔化学奖。2
1932年,弗里德里希·洪德(F.Hund)将共价键分为σ键、π键、δ键三种,使价键理论进一步系统化,与经典的化合价理论有机地结合起来。2
同年,美国化学家罗伯特·马利肯(Robert S.Mulliken)提出分子轨道理论。认为化合物中的电子不属于某个原子,而是在整个分子内运动。他的方法和经典化学相距太远,计算又很繁琐,一时不被化学界所接受。后经过罗伯特·密立根(Robert A.Millikan)、菲利普·伦纳德(Philipp Lenard)、埃里希·休克尔(Erich Hückel)等人的完善,在化学界逐渐得到认可。2
1940年,亨利·希吉维克(H.Sidgwick)和托马斯·坡维尔(Thomas A.Powell)在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经罗纳德·吉列斯比(R.J.Gillespie)和罗纳德·尼霍尔姆(R.S.Nyholm)在20世纪50年代加以发展,定名为价层电子对互斥理论,简称VSEPR。VSEPR与轨道杂化理论相结合,可以半定量地推测分子的成键方式与分子结构。
1951年,福井谦一提出前线轨道理论,认为,分子中能量最高的分子轨道(HOMO)和没有被电子占据的,能量最低的分子轨道(LUMO)是决定一个体系发生化学反应的关键,其他能量的分子轨道对于化学反应虽然有影响但是影响很小,可以暂时忽略。HOMO和LUMO便是所谓前线轨道。
1965年,美国化学家罗伯·伍德沃德(Rober B.Woodward)与霍夫曼参照福井谦一的前线轨道理论,提出了分子轨道对称守恒原理。分子轨道理论得到了新的发展。2
由于计算机技术的迅猛发展,和蒙特卡罗方法的应用,量子化学与计算机化学日新月异,对分子结构的推算变得愈发精确期间也诞生了一大批优秀的化学家,据估计,21世纪中期,量子化学还将有新的突破。
主要特点
饱和性
在共价键的形成过程中,因为每个原子所能提供的未成对电子数是一定的,一个原子的一个未成对电子与其他原子的未成对电子配对后,就不能再与其它电子配对,即,每个原子能形成的共价键总数是一定的,这就是共价键的饱和性。3
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系3,是定比定律(law of definite proportion)的内在原因之一。
方向性
除s轨道是球形的以外,其它原子轨道都有其固定的延展方向,所以共价键在形成时,轨道重叠也有固定的方向,共价键也有它的方向性,共价键的方向决定着分子的构形。3
影响共价键的方向性的因素为轨道伸展方向。
极性
共价键可以是极性的或非极性的,这取决于连接在一起的原子的电负性差异。如果两个原子的电负性相近,则共价键可能是非极性的,电子对均匀地分布在原子之间。然而,如果原子间的电负性差异较大,则共价键可能是极性的,电子对会倾向于偏移到电负性较高的原子附近。3
弹性
共价键具有一定的弹性,即它们可以在一定范围内进行扭曲和变形,而不会完全断裂。这种弹性使得共价键能够在一定条件下承受外部应力或变形,并在条件恢复正常时恢复其原始结构。
稳定性
共价键通常是非常稳定的化学键,可以在相对较宽的温度和压力范围内存在。这种稳定性使得共价键在自然界和化学反应中起着重要的作用。
化学性质
化学变化的本质是旧键的断裂和新键的形成,化学反应中,共价键存在两种断裂方式,在化学反应尤其是有机化学中有重要影响。
均裂与自由基反应
共价键在发生均裂时,成键电子平均分给两个原子(团),均裂产生的带单电子的原子(团)称为自由基,用“R·”表示,自由基具有反应活性,能参与化学反应9,自由基反应一般在光或热的作用下进行。
异裂与离子型反应
共价键发生异裂时生成正、负离子10,例如氯化氢在水中电离成氢离子和氯离子。有机物共价键异裂生成的碳正离子和负离子是有机反应的活泼物种,往往在生成的一瞬间就参加反应,但可以证明其存在。3
由共价键异裂引发的反应称离子型反应,其下又可分为两种
·亲电反应(electrophilic reaction)
·亲核反应(nucleophilic reaction)
离子型反应一般在酸碱或极性物质的催化下进行。
理论模型
路易斯理论
路易斯理论,又称“八隅体规则”、“电子配对理论”是最早提出的,具有划时代意义的共价键理论,它没有量子力学基础,但因为简单易懂,也能解释大部分共价键的形成,至今依然出现在中学课本里。4
共用电子对理论有以下几点:
1、原子最外层达到8电子时是稳定结构,化合物中的所有原子的最外层价电子数必须为8(氢为2);
2、原子间形成共价键时,可通过共用电子的方式使最外层达到8(2)电子稳定结构。
路易斯理论的电子配对思想为价键理论的发展奠定了基础。值得注意的是,路易斯理论尚不完善,它无法说明电子配对的原因和实质;此外,不符合“八隅体规则”的化合物也有很多,例如:三氟化硼(6电子)、五氯化磷(10电子)、六氟化硫(12电子)。
价键理论
价键理论是基于路易斯理论电子配对思想发展起来的共价键理论。价键理论将应用量子力学解决氢分子问题的成果推广到其他共价化合物中,成功解释了许多分子的结构问题。
海特勒-伦敦法
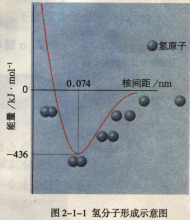
沃尔特·海特勒(W.H.Heitler)和弗里茨·伦敦(F.London)在运用量子力学方法处理氢气分子的过程中,得到了分子能量E和核间距R之间的关系曲线,发现:若两个氢原子自旋方向相反,随着轨道的重叠(波函数相加)会出现一个概率密度较大的区域,氢原子将在系统能量最低核间距处成键;若两个氢原子自旋方向相同,则相减的波函数单调递减,系统能量无限趋近E=0,没有最低点,无法成键。因此,价键理论通过对氢分子的研究阐明了电子配对的内在原因和共价键的本质,价键理论就在HL的推广中诞生。5
轨道杂化理论
价键理论在解释分子中各原子分布情况时,莱纳斯·鲍林(L.Pauling)提出了轨道杂化理论。理论要点有
1、中心原子能量相近的不同轨道在外界的影响下会发生杂化,形成新的轨道,称杂化原子轨道,简称杂化轨道;
2、杂化轨道在角度分布上,比单纯的原子轨道更为集中,因而重叠程度也更大,更加利于成键;
3、参加杂化的原子轨道数目与形成的杂化轨道数目相等,不同类型的杂化轨道,其空间取向不同。
杂化类型 | 杂化轨道夹角 | 空间取向4 |
|---|---|---|
sp^1 | 180 | 直线型 |
sp^2 | 120 | 平面正三角形 |
sp^3 | 109°28' | 正四面体 |
sp^3d (dsp^3) | 90 120 | 三角双锥 |
sp^3d^2 (d^2sp^3) | 90 | 正八面体 |
注:此为杂化轨道的空间取向,不是化合物的结构
在化合物中,这些轨道可能被孤对电子或单电子填充,例如,N原子进行sp²杂化形成的NO2分子中,有一个单电子,NO2的空间结构是折线形(正三角形的一个顶点是单电子,电子是“看不见”的)。
互斥理论
价层电子对互斥理论(VSEPR Theory)是一个用来预测单个共价分子形态的化学模型。理论通过计算中心原子的价层电子数和配位数来预测分子的几何构型,其理论要点有:
1、共价分子中,中心原子周围电子对排布的几何形状,主要决定于中心原子的价电子层中的电子对数(包括成键电子对和孤对电子)。这些电子的位置倾向于分离的尽可能远一些,使彼此受到的排斥力最小;
2、电子层中电子对相互排斥作用的大小,取决于电子对间的相互角度和电子对的成键情况。相距角度小,排斥力大。成键电子对因受两个原子吸引,电子云较为紧缩,对其相邻电子对的斥力小于仅受一个原子核吸引的孤对电子对其相邻电子对的斥力。即,电子对间斥力大小顺序为:孤对电子-孤对电子>孤对电子-成键电子对>成键电子对-成键电子对;
3、分子中的双键、三键当作单键处理;
推测分子构形
设中心原子为A,其余n个配位原子均用B表示,m对孤对电子用E表示,则该物质可表示为ABnEm。令z=n+m,B和E都用Y表示,则该物质可表示为AYz,这里的Y就表示中心原子的价电子层中的电子对,z就表示中心原子的价电子层中的电子对数。我们可根据如下公式推测分子构型:
n由化学式即可看出
m=1/2(中心原子价电子数-配位原子提供的电子总数±离子电荷数)
z=n+m
Z=n+m | 2 | 3 | 4 | 5 | 6 |
结构形式 | 直线型 | 平面三角形 | 四面体 | 三角双锥 | 八面体 |
注:更详细的表参见wikipedia,VSEPR theory(扩展阅读)
分子轨道理论
分子轨道理论是比价键理论更精确的方法12,其理论要点有
1、分子中的电子不属于某个原子轨道,而属于整个分子;
2、分子轨道由原子轨道线性组合而成,分子轨道数目等于组成分子轨道的原子轨道数目,其中些轨道能量降低,成为“成键轨道”另一些能量升高,成为“反键轨道”,还有一些能量不变,称“非键轨道”;
3、原子轨道在线性组合时,遵守“对称性匹配原则”、“能量相近原则”、“最大重叠原则”;
4、电子在分子轨道中排布时,遵守“能量最低原理”、“泡利不相容原理”、“洪特规则”;
分子轨道理论能解释一些价键理论无法解释的现象,比如氧分子的顺磁性。
氧原子的外层电子数为6,这六个电子中的四个组成两对,其它两个单独存在。
这两个单独的电子与另一个原子中相应的单独的电子结合组成两个新的共用的电子对,由此达到电子饱和的状态。
 需要说明的是这里所描述的氧分子的模型是一个简化了的模型,实际上的氧分子要比这里描述的要复杂得多,因为这6个外层原子分布在不同的轨道上,因此它们不能形成这样简单的电子对。实际上的氧分子有三对共用的电子对和两个单独的电子。
需要说明的是这里所描述的氧分子的模型是一个简化了的模型,实际上的氧分子要比这里描述的要复杂得多,因为这6个外层原子分布在不同的轨道上,因此它们不能形成这样简单的电子对。实际上的氧分子有三对共用的电子对和两个单独的电子。
分类
共价键从不同的角度可以进行不同的分类,每一种分类都包括了所有的共价键(只是分类角度不同)。
按成键方式
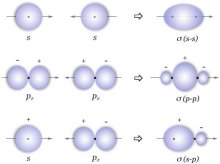 σ键(sigma bond)13
σ键(sigma bond)13
由两个原子轨道沿轨道对称轴方向相互重叠导致电子在核间出现概率增大而形成的共价键,叫做σ键,可以简记为“头碰头”(见图6)。σ键属于定域键,它可以是一般共价键,也可以是配位共价键。一般的单键都是σ键。原子轨道发生杂化后形成的共价键也是σ键。由于σ键是沿轨道对称轴方向形成的,轨道间重叠程度大,所以,通常σ键的键能比较大,不易断裂,而且,由于有效重叠只有一次,所以两个原子间至多只能形成一条σ键。
π键(pi bond)
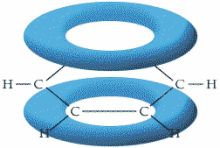
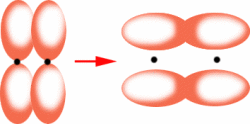 成键原子的未杂化p轨道,通过平行、侧面重叠而形成的共价键,叫做π键,可简记为“肩并肩”3(见图7)。π键与σ键不同,它的成键轨道必须是未成对的p轨道。π键性质各异,有两中心,两电子的定域键,也可以是共轭Π键和反馈Π键。两个原子间可以形成最多2条π键,例如,碳碳双键中,存在一条σ键,一条π键,而碳碳三键中,存在一条σ键,两条π键。
成键原子的未杂化p轨道,通过平行、侧面重叠而形成的共价键,叫做π键,可简记为“肩并肩”3(见图7)。π键与σ键不同,它的成键轨道必须是未成对的p轨道。π键性质各异,有两中心,两电子的定域键,也可以是共轭Π键和反馈Π键。两个原子间可以形成最多2条π键,例如,碳碳双键中,存在一条σ键,一条π键,而碳碳三键中,存在一条σ键,两条π键。
 π键中的π电子可以吸收紫外线并被激发,所以,含有π键的化合物有抵御紫外线的功能,防晒霜正是利用了这个原理防护紫外线对人的伤害。共轭π键具有特殊的稳定性,例如苯环中存在6中心6电子的大π键14,显现出芳香性,不易发生加成和氧化反应,而易发生亲电取代,与苯环有类似键型的化合物包括部分杂环化合物、稠环烃和其他烃类,化学家埃里希·休克尔通过分子轨道计算得出了环烯烃芳香性判定的休克尔规则(亦名4n+2规则),其它常见的非苯芳烃包括薁、[18]轮烯等;而石墨的每一层都有一个无穷大的π键,电子在这个超大π键中可以自由移动,类似于金属键,这也是石墨可以横向导电的原因。3
π键中的π电子可以吸收紫外线并被激发,所以,含有π键的化合物有抵御紫外线的功能,防晒霜正是利用了这个原理防护紫外线对人的伤害。共轭π键具有特殊的稳定性,例如苯环中存在6中心6电子的大π键14,显现出芳香性,不易发生加成和氧化反应,而易发生亲电取代,与苯环有类似键型的化合物包括部分杂环化合物、稠环烃和其他烃类,化学家埃里希·休克尔通过分子轨道计算得出了环烯烃芳香性判定的休克尔规则(亦名4n+2规则),其它常见的非苯芳烃包括薁、[18]轮烯等;而石墨的每一层都有一个无穷大的π键,电子在这个超大π键中可以自由移动,类似于金属键,这也是石墨可以横向导电的原因。3
d-pπ键的讨论
以H3PO4为例,说明d-pπ键的形成 在(HO)3PO中P原子采取sp3杂化,P原子中3个sp3杂化轨道中的3个单电子与OH基团形成三个σ键,第四个sp3杂化轨道上的孤对电子对必须占有O原子的空的2p轨道。而基态氧原子2p轨道上的电子排布没有空轨道,但为了容纳P原子上的孤对电子对,O原子只好重排2p轨道上电子而空出一个2p轨道来容纳P原子的孤对电子对,形成P︰O的σ配键。
氧原子2p轨道上的孤对电子对反过来又可以占有P原子的3d空轨道,这两个p-d轨道只能“肩并肩”重叠,形成π键,称为d-pπ键。
d-p π键的应用
(a) 可以解释共价分子几何构型。 (SiH3)3N与(CH3)3N有不同的几何构型,前者为平面三角形,后者为三角锥型。这是由于在(SiH3)3N中N原子可以采取sp2杂化,未杂化的2p轨道(有一对孤对电子对)可以“肩并肩”地与Si原子的3d空轨道重叠而形成d-pπ键,使平面三角形结构得以稳定。(CH3)3N中的C原子不存在d价轨道,所以原子必须采取sp3杂化,留给孤对电子对以合适的空间。
(b) 可以解释Lewis碱性的强弱。比较H3C-O-CH3与H3Si-O-CH3的碱性,前者的碱性强于后者的碱性。这也是由于在H3Si-O-CH3中O原子上的孤对电子对可以占有Si原子的3d空轨道,形成d-pπ键,从而减弱了O原子的给出电子对能力,使得后者的Lewis碱性减弱。
(c) 可以解释键角的变化。对于NH3与NF3,∠HNH>∠FNF,而对于PH3与PF3,∠HPH<∠FPF。两者是反序的,这是因为后者是由于F原子上的孤对电子对占有P原子上的3d空轨道,增强了P原子上的电子云密度,使成键电子对之间的排斥力增大,所以键角变大。
离域π键
形成条件:所有参与离域π键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取sp或sp2杂化;所有参与离域π键的原子都必须提供一个或两个相互平行的p轨道;参与离域π键的p轨道上的电子数必须小于2倍的p轨道数。
SO3中S原子采取sp2杂化,未参与杂化的3p轨道上存在一对电子,由于在sp2杂化轨道上有一对电子,所以SO3中氧原子的2p轨道上的电子发生重排而空出了一个2p轨道来容纳S原子的2p2杂化轨道上的电子对,则该氧原子提供的平行的2p轨道上也是一对电子,所以SO3中S原子的一个3p轨道和3个O原子的2p轨道(共四个相互平行的p轨道)提供的p电子数为:2+2+1+1=6。
δ键(delta bond)
 由两个d轨道四重交盖而形成的共价键称为δ键,可简记为“面对面”(见图9)。
由两个d轨道四重交盖而形成的共价键称为δ键,可简记为“面对面”(见图9)。
δ键只有两个节面(电子云密度为零的平面)。从键轴看去,δ键的轨道对称性与d轨道的没有区别,而希腊字母δ也正来源于d轨道。
δ键常出现在有机金属化合物中,尤其是钌、钼和铼所形成的化合物。通常所说的“ 内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
