硝酸,是一种具有强氧化性、腐蚀性的一元无机强酸。是六大无机强酸之一,也是一种重要的化工原料,化学式为HNO3,分子量为63.01,其水溶液俗称硝镪水或氨氮水,纯品为无色透明发烟液体,有酸味。在工业上可用于制化肥、农药、炸药、染料等;在有机化学中,浓硝酸与浓硫酸的混合液是重要的硝化试剂。硝酸的酸酐是五氧化二氮(N2O5)。
2017年,硝酸被列入《易制爆危险化学品名录》8,并按照《易制爆危险化学品治安管理办法》管控9。
研究简史
国外发展史
 公元八世纪,阿拉伯炼金术士贾比尔·伊本·哈扬(Jabir ibn Hayyan)在干馏硝石的时候发现并制得了硝酸,这是人类关于硝酸最早的记录7。
公元八世纪,阿拉伯炼金术士贾比尔·伊本·哈扬(Jabir ibn Hayyan)在干馏硝石的时候发现并制得了硝酸,这是人类关于硝酸最早的记录7。
1905年,挪威出现了电弧法生产硝酸的工厂,这是历史上最早的硝酸工业化尝试7。
1908年,德国建成了以铂网为催化剂的日产能力3吨的硝酸厂7。
1913年,合成氨问世,氨氧化法生产硝酸开始进入工业化阶段,这种方法一百多年后依然是世界上生产硝酸的主要方法7。
国内发展史
1935年,在中国化学家侯德榜的领导下,中国建成了第一座兼产合成氨、硝酸、硫酸和硫酸铵的联合企业——永利宁厂(现南京化学工业公司)7。
1937年2月,永利宁厂第一次生产出优质的硝酸7。
1951年5月,大连化学厂产出了硝酸产品。
1952~1958年之间,中国先后在吉林、兰州、太原等地建成了综合法硝酸装置,其中兰州化学工业公司的浓硝酸在1997年之前的几十年里一直蝉联着中国最大装置的桂冠7。
1980年起,中国国内硝酸产业的发展开始加速,总产量每年以10%~15%的速度增长。特别是90年代后期,中国的硝酸工业进入蓬勃发展时期,总产量年增速达到了15%~20%。但这个时期中国硝酸生产技术仍然比较落后,早期的常压法、综合法工艺装置多为淘汰型生产线,高压法装置全部靠进口国外的二手设备。不久,山西化肥厂(现天脊集团)从国外引进了中国第一套双加压硝酸装置,从此中国的硝酸工业开始向国际先进行列迈进7。
1999年,西安陕鼓动力股份有限公司成功研制出中国第一套“四合一”机组,并应用于云南云峰化学工业公司,从此加快了中国硝酸双加压工艺国产装备向国际先进水平进军的步伐。云南云峰化学工业公司作为第一个使用国产化“四合一”机组的硝酸生产企业,坚定了中国国内硝酸生产企业选择国产装备的信心7。
2000年后,中国的硝酸工业进入高速发展期,年总产量以高于18%的速度快速增长,拥有各种种类、规模不等的生产厂家约60多家7。
2007年11月,中国第一套在满负荷生产条件下实现副产蒸汽自足、还能富余外供蒸汽的国产化双加压法硝酸装置在新乡市永昌化工有限责任公司诞生,标志着中国自己研制的国产硝酸装置完全能够替代进口,中国国内硝酸工业摆脱了对进口装备的依赖7。
自然分布
自然界中的硝酸主要由雷雨天生成的一氧化氮或微生物生命活动放出二氧化氮形成。人类活动也产生氮氧化物,全世界人为污染源每年排出的氮氧化物大约为5300万吨,这些氮氧化物也会形成硝酸。硝酸性质不稳定,因而无法在自然界长期存在,但硝酸的形成是氮循环的一环。
分子结构数据
硝酸分子为平面共价分子,中心氮原子sp2杂化,未参与杂化的一个p轨道与两个端氧形成三中心四电子键。硝酸中的羟基氢与非羟化的氧原子形成分子内氢键,这是硝酸酸性不及硫酸、盐酸,熔沸点较前两者低的主要原因。
键长:
O-N:119.9pm;O'-N:121.1pm;O-H:96.4pm;N-OH:140.6pm。
键角:
O'-N-O:130.27°;O-N-OH:113.85°;O'-N-OH:115.88°;N-O-H:102.2°。
分子结构数据:
1、摩尔折射率:9.60
2、摩尔体积(cm3/mol):38.8
3、等张比容(90.2K):107.4
4、表面张力(dyne/cm):58.6
5、极化率(10-24cm3):3.80
理化性质
物理性质
纯硝酸为无色透明液体,浓硝酸为淡黄色液体(溶有二氧化氮),正常情况下为无色透明液体,有窒息性刺激气味。浓硝酸中的硝酸含量为68%左右,易挥发,在空气中产生白雾(与浓盐酸相同),是硝酸蒸汽(一般来说是浓硝酸分解出来的二氧化氮)与水蒸汽结合而形成的硝酸小液滴。能与水混溶。能与水形成共沸混合物。对于稀硝酸,一般认为浓稀之间的界线是6mol/L,市售普通试剂级硝酸浓度约为68%左右,而工业级浓硝酸浓度则为98%。通常发烟硝酸浓度约为98%。
相对密度(水=1):1.50(无水)
熔点:-42℃(无水)
沸点:83℃(无水)
相对蒸气密度(空气=1):2~3
饱和蒸气压(kPa):6.4(20℃)
临界压力(MPa):6.89
辛醇/水分配系数:0.21
溶解性:与水混溶,溶于乙醚。
黏度(mPa·s,20ºC):0.89
比热容(kJ/(kg·K),98.15%):1.99
比热容(kJ/(kg·K),90.33%):2.22
比热容(kJ/(kg·K),70.00%):2.56
比热容(kJ/(kg·K),40.00%):2.80
电导率(S/m,30.42%):7008
电导率(S/m,51.78%):5554.2
电导率(S/m,78.96%):1945.1
电导率(S/m,98.50%):167.8
化学性质
不稳定性
浓硝酸不稳定,遇光或热会分解而放出二氧化氮,分解产生的二氧化氮溶于硝酸,从而使外观带有浅黄色。11但稀硝酸相对稳定,70%~90%硝酸在0℃,阴暗处不发生分解10。浓硝酸氧化性强,反应方程式:
,
![]()
强酸性
一般情况下认为硝酸在水溶液中能够完全电离,产生大量氢离子:
![]()
硝酸作为氮元素的最高价(+5)水化物,具有很强的酸性。
酯化反应
硝酸能与醇发生酯化反应生成对应的硝酸酯,即“酸脱羟基醇脱氢”与羧酸的酯化机理相同。5硝酸的酯化反应被用来生产硝化纤维,方程式见下:
3nHNO3 + [C6H7O2(OH)3]n——→[C6H7O2(O-NO2)3]n + 3nH2O
硝化反应
浓硝酸或发烟硝酸与脱水剂(浓硫酸、五氧化二磷)混合可作为硝化试剂对一些化合物引发硝化反应,硝化反应属于亲电取代反应(electrophilic substitution),反应中的亲电试剂为硝鎓离子,脱水剂有利于硝鎓离子的产生。5
最为常见的硝化反应是苯的硝化:
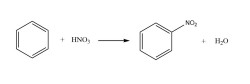
氧化还原反应
硝酸能使羊毛织物和动物组织变成嫩黄色。硫、磷单质经硝酸氧化可生成硫酸和磷酸。能溶解多种金属形成硝酸盐溶液。铁、铬、铝等金属在浓硝酸中处于钝态而不作用,但可溶于稀硝酸中。锡、锑、钼等则生成不溶性氧化物。11
由于硝酸的强氧化性,所以不可以通过硝酸来制取氢气,稀硝酸与金属反应生成一氧化氮,浓硝酸与金属反应同样也会生成一氧化氮,但浓硝酸的氧化性比稀硝酸强,一氧化氮刚反应出来,就被硝酸根离子在氢离子存在的情况下氧化成二氧化氮。方程式如下:
![]()
碘化氢与不同浓度的硝酸反应,把碘离子分别氧化成碘单质和碘酸根离子:
![]()
![]()
硝酸助燃,与可燃物混合会发生爆炸。
硝酸分子中氮元素为最高价态(+5)因此硝酸具有强氧化性,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为二氧化氮,稀硝酸主要为一氧化氮,更稀的硝酸可以被还原为一氧化二氮、氮气、硝酸铵等。实际上随着反应的进行,硝酸浓度逐渐降低,所有还原产物都可能出现。11
硝酸有关电势图见下:(标况 E/V)11
HNO3—0.803→NO2—1.07→HNO2—0.983→NO—1.591→N2O—1.77→N2—0.27→NH4+
HNO3—0.957→NO
HNO3—1.11→N2O
HNO3—1.24→N2
HNO3—0.88→NH4+
典型反应22
浓硝酸:
![]()
![]()
稀硝酸:
![]()
![]()
纯硝酸可以发生自偶电离:
![]()
![]()
![]()
生产工艺
稀硝酸
稀硝酸生产工艺
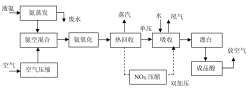
我国生产硝酸的主要工艺方法可分为以下几类:常压法、综合法、中压法、高压法、双加压法等,其原理是对氨氧化和酸吸收两道工序施加压力的差异。目前,主要运用双加压法生产,在中压(0.35~0.6 MPa)的环境下对氨进行氧化,在高压(1.0~1.5 MPa)的环境下吸收NOX19。
稀硝酸生产的原理是将氨和空气(或纯氧气)混合后,在高温(850~950°C)和催化剂的条件下反应生成氧化氮气体,然后与水反应生成稀硝酸,反应方程式如下:17
4ΝΗ3+5Ο2=4ΝΟ+6Η2Ο
2ΝΟ+Ο2=2ΝΟ2
3ΝΟ2+Η2Ο=2ΗΝΟ3+ΝΟ
浓硝酸
“浓硝酸”(CNA)通常是指几乎无水的硝酸(高于96%HNO3)。工业上生产浓硝酸用三种不同方法12,即:
间接法
使用脱水剂提馏稀硝酸,常用的脱水剂为:(1)硝酸镁;(2)浓硫酸。
硝镁法浓硝酸工艺利用浓硫酸的脱水性, 与稀硝酸混合, 通过蒸汽直接加热, 在填料浓缩塔内破坏硝酸的共沸点进行蒸馏, 蒸馏出来的浓硝酸蒸汽通过冷凝器将其冷凝, 然后再进一步冷却, 即得到浓硝酸。13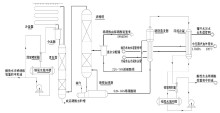
直接法
氨催化氧化取NO,NO经浓硝酸氧化成高浓度的NO2,NO2在低温下液化为N2O4,液态N2O4与纯氧及水在高压釜内直接氧化制取浓硝酸。14
超共沸酸精馏法
超共沸酸精馏法将氨氧化后的氨氧化物冷却后析出冷凝酸,冷凝酸经酸水漂白塔用空气提取氮的氧化物返回系统,将稀酸水排出系统,脱水后系统总物料中将生成浓度超过稀硝酸共沸点所对应浓度的稀硝酸,该稀硝酸经氧化塔、超共沸吸收塔、次共沸吸收塔和真空精馏塔等制取浓硝酸。15
应用领域
硝酸是重要化工原料,主要用于制造硝酸铵、硝酸铵钙、硝酸磷肥、氮磷钾等复合肥料。作为制硝酸盐类氮肥(如硝酸铵、硝酸钾等)、王水、硝化甘油、硝化纤维素、硝基苯、苦味酸和硝酸酯的必需原料,也用来制取含硝基的炸药。
有机工业
用于制造四硝基甲烷、硝基己烷、1-硝基丙烷、2,4-二硝基苯氧乙醇等硝基化合物。
染料工业
用于对硝基苯甲醚、4,4’-二硝基二苯醚、对硝基苯酚、2,5-二氯硝基苯等染料中间体的合成。
涂料工业
用于制造硝基清漆和硝基瓷漆。
医药工业
用于制造硝基苯乙酮。
水处理
硝酸可用作碳素钢、不锈钢设备的清洗除锈剂,用在污水、废水的氧化还原处理过程中。在污水的生物法处理过程中,可用作微生物养分中的氮源等。
其他作用
硝酸作为氧化剂可氧化醇、苯胺及其他化学品。并已经用于火箭的推进剂。硝酸也是制造钙、铜、银、 内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 