
心血管疾病(cardiovascular diseases,CVD)是一类涉及心脏和血管的疾病。心血管疾病死亡率占所有疾病患者死亡人数的40%以上,是人类死亡的主要病因,在全球范围内造成巨大的经济负担,属于严重的公共健康问题。心肌梗死(myocardial infarction,MI)是最常见的心血管疾病之一。由于氧气(O2)和营养物质供应减少引起代谢严重失衡,导致微环境稳态障碍,大量细胞死亡,炎症细胞浸润,成纤维细胞活化等。越来越多的证据表明,长链非编码RNA(lncRNA)在调节心肌细胞死亡和心肌重塑中具有重要作用,并有可能成为未来治疗心肌梗死的新靶点。

哈尔滨医科大学王宁教授与杨宝峰院士研究团队在中国工程院院刊《Engineering》2023年1月刊发表了题为“CPAL, as a New Mediator of Cardiomyocyte Metabolic Alterations and Pyroptosis, Regulates Myocardial Infarction Injury in Mice”(作为一种新的心肌细胞代谢改变和焦亡调节剂,CPAL可调节小鼠心肌梗死损伤)的研究性文章,旨在探究lncRNA在调节心肌梗死后心肌重构中的作用及机制,为改善缺血/炎症引起的心脏功能障碍提供了一个令人兴奋的途径。此外,文章还揭示了AK009126(心肌细胞焦亡相关lncRNA,CPAL)可能是改善心肌梗死患者心脏功能的关键治疗靶点。
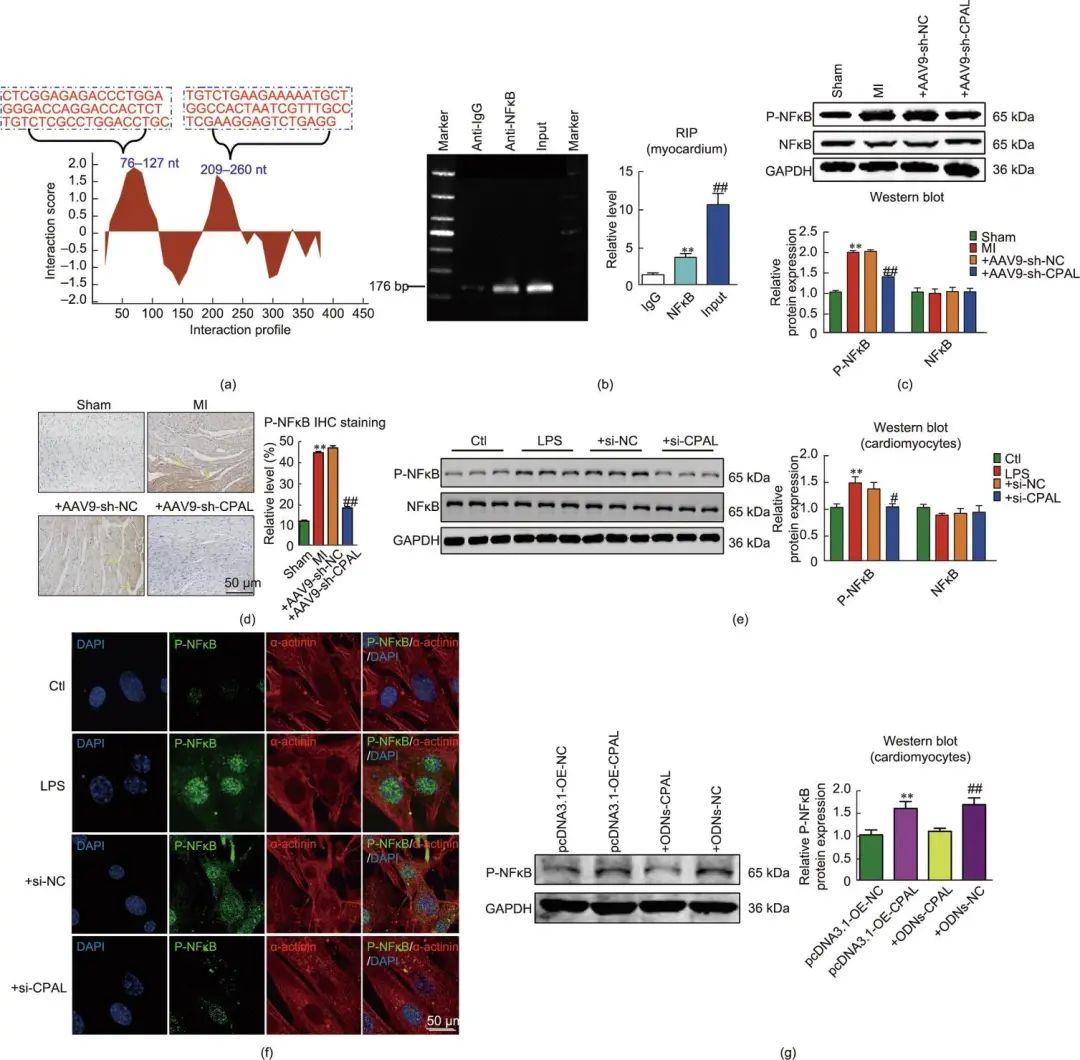
文章表明,CPAL在心肌梗死小鼠梗死边缘区心肌组织中上调,并导致了心肌重塑和心脏功能障碍。而敲减内源性CPAL可部分抑制缺血心肌的糖脂质代谢改变,并减少心肌梗死后心肌细胞焦亡的现象。此外,文章发现CPAL可直接与核因子kappa B(NFκB)蛋白相互作用并增加其磷酸化水平,磷酸化的NFκB可以从细胞质转运到细胞核中,并增加下游基因转录活性;这可能是CPAL调控心肌梗死后心脏代谢改变和焦亡的基础。
文章指出,NFκB是心肌糖脂代谢的关键调控因子。NFκB的下游靶基因也参与糖脂和能量代谢。此外,文章发现CPAL缺失通过调节缺血心肌中葡萄糖转运蛋白4(GLUT4)、己糖激酶1(HK1)和分化抗原簇36(CD36)蛋白的表达,增强了葡萄糖和脂肪酸的利用,改善了能量代谢。总之,文章揭示了CPAL作为一种有害lncRNA,通过靶向磷酸化核因子κB-P65(P-NFκB P65)信号通路,促进心肌梗死过程中糖脂代谢紊乱和心肌细胞焦亡。然而,尚不清楚CPAL介导的代谢改变和NFκB介导的心肌细胞焦亡的之间的先后顺序,未来还有待进一步探讨和研究。
引用信息:Jiamin Li, Hongru Xue, Ning Xu, Liling Gong, Ming Li, Sijia Li, Di Huang, Qingwei Zhang, Pengyu Li, Qingsui Li, Hang Yu, Yining Liu, Yadong Xue, Haixin Chen, Jiali Liu, Wanyu Zhang, Mingbin Liu, Siyu Chang, Xianzhi Lang, Xingmiao Zhao, Weijie Du, Benzhi Cai, Ning Wang, Baofeng Yang. CPAL, as a New Mediator of Cardiomyocyte Metabolic Alterations and Pyroptosis, Regulates Myocardial Infarction Injury in Mice [J]. Engineering, 2023, 20(1): 49-62.
原文链接:https://www.engineering.org.cn/engi/EN/10.1016/j.eng.2022.08.012
来源: Engineering前沿


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 Engineering前沿
Engineering前沿 
