癌症是人类发病率和死亡率第二高的疾病,我国2022年癌症新发病例482万、死亡病例257万,均居世界首位,以至于很多民众“谈癌色变”。
肿瘤靶向递药是已在临床上广泛应用的癌症治疗手段,顾名思义,科学家们希望将装载有纳米肿瘤药的“包裹”精确递送至肿瘤细胞位置,并将其彻底清除。但现实情况是,传统递药系统的肿瘤靶向效率极低,靶向治疗的疗效有限。

浙江大学化学工程与生物工程学院教授申有青带领项目团队,经过十五年的科研攻关,从设计合成医用功能高分子入手,发现了肿瘤主动“索取”药物的肿瘤主动递药新机制,构建了智能递药系统,克服了“从血管出不来”和“瘤内进不去”两大瓶颈难题,显著提高了靶向治疗的疗效。
6月24日上午,2023年度国家科学技术奖在北京揭晓,这项成果获得国家自然科学奖二等奖。
创新机制,攻克两大瓶颈问题
从小动物模型肿瘤的研究提出的传统理论,发现肿瘤毛细血管有众多孔隙,递药系统可以通过这些孔隙“漏”进瘤内实现富集,即EPR效应,研究人员也依此设计了诸多递药系统。然而,临床实践发现,人的肿瘤血管孔隙少,递药系统实际上难以从血管中“漏”出来进而进入肿瘤组织,同时这些递药系统也难以扩散到达瘤内深处。“从血管中出不来”“钻不进肿瘤”一直是肿瘤靶向递药悬而未解的两大难题,严重制约了药效发挥。

正电性高分子诱导细胞转胞运的现象(动画)
既然递药系统自身的“被动扩散”效果有限,那么能否转换思路,引导癌症细胞进行“主动传递”?从这个思路出发,团队首次发现了高分子触发细胞转胞运的现象,即细胞可以主动吞噬高分子载体,然后再从其它部位将其吐出去。在这个发现的基础上,团队建立起肿瘤主动递药机制。与传统递药系统截然不同的是,曾经只是被动等待的肿瘤细胞被激活了,它们不仅会主动将血液中的递药系统抓取到肿瘤组织中来,而且在自己“饱餐一顿”之后,还乐于将药物“分享”给其他肿瘤细胞。而曾经大费周章地在血液中寻找通往肿瘤组织入口的递药系统,现在可以轻轻松松地“钻”进敌军内部,并将肿瘤细胞一网打尽。由此,肿瘤靶向递药获得了变革性的疗效。
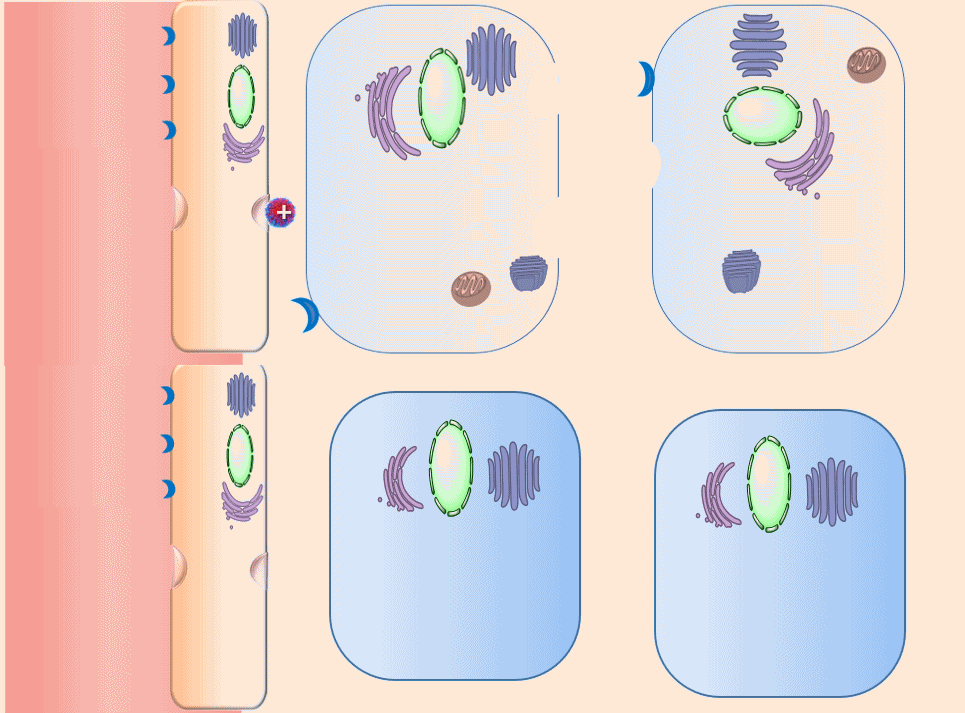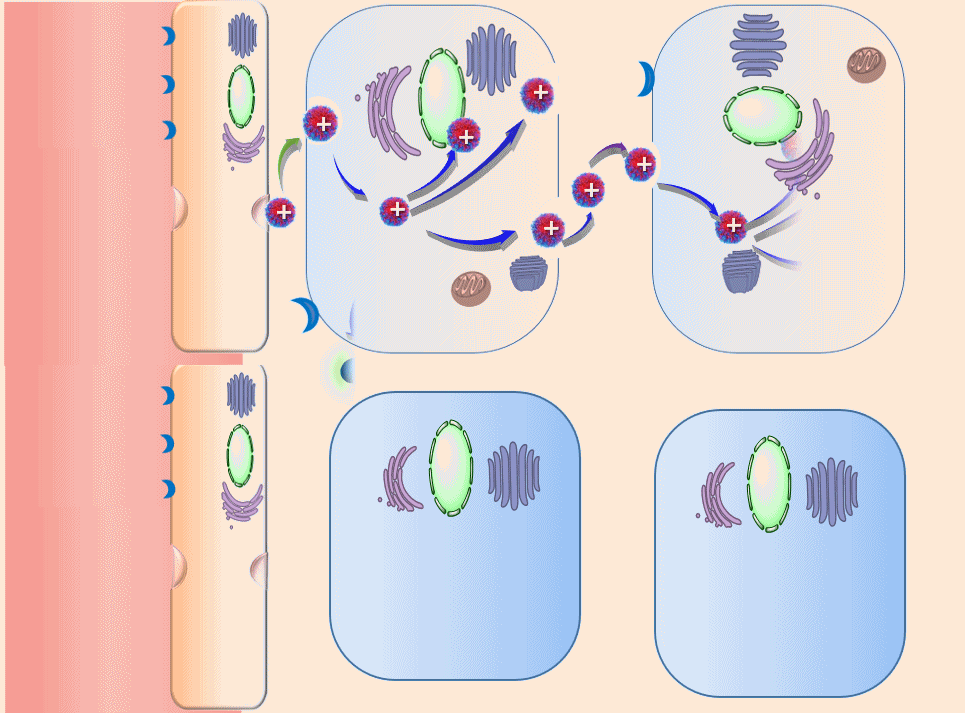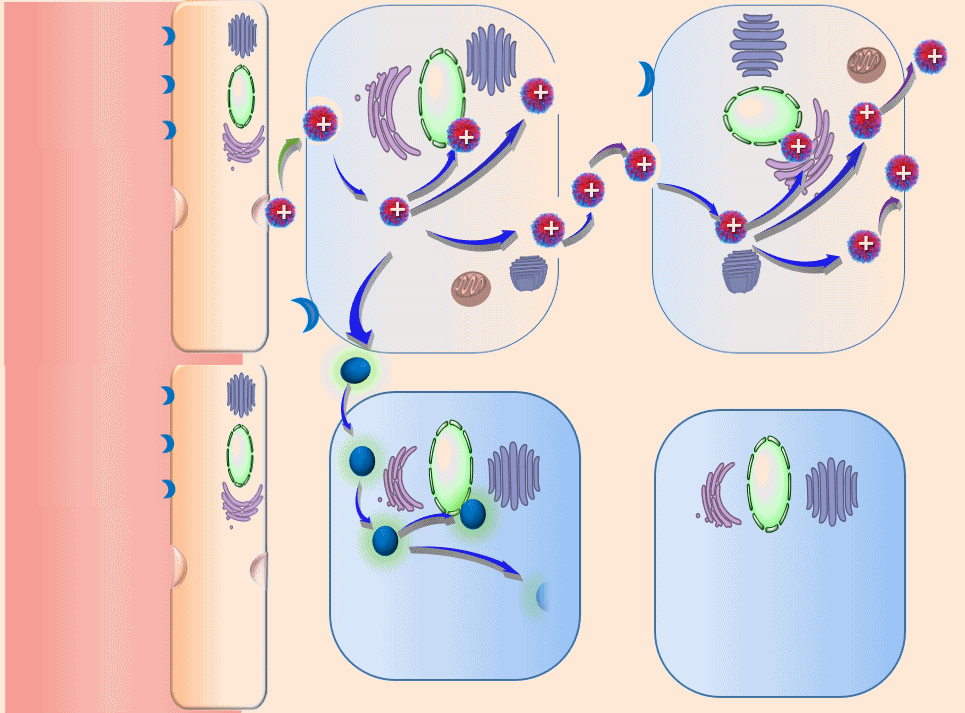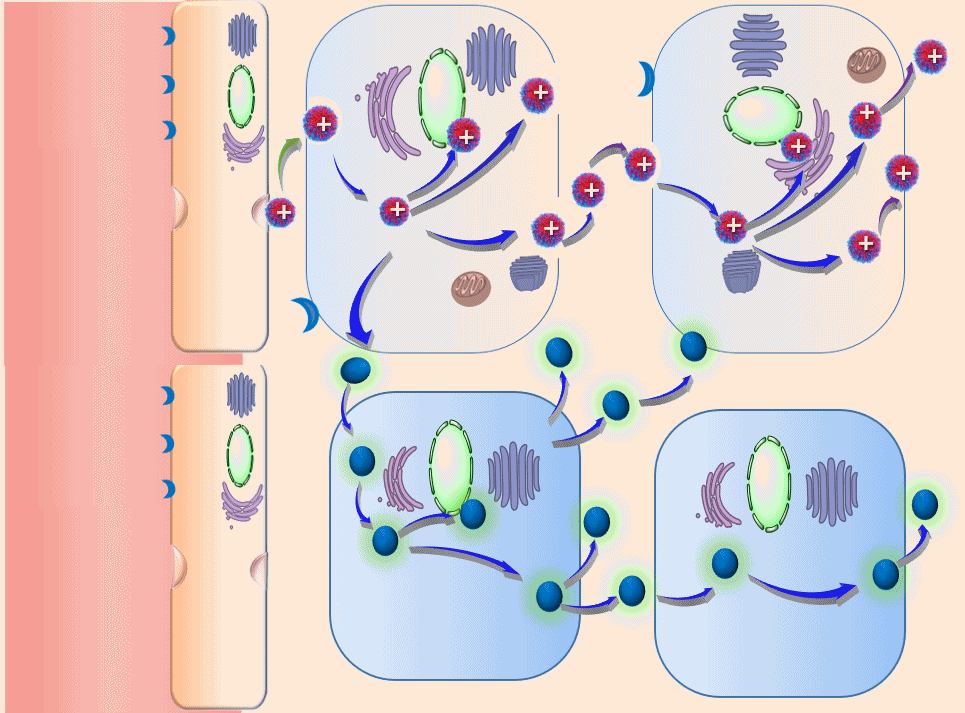
高分子诱导细胞间连续转胞运“主动”渗透肿瘤的原理(动画)
在该理论的指导下,团队利用γ-谷氨酰转肽酶在胰腺癌等肿瘤高表达的特点,设计合成了酶响应性高分子聚合物,可使得在血液中原本呈现为电中性或电负性的纳米药,在达到肿瘤之后可快速“转性”,呈现出正电性,进而完成纳米药的跨细胞快速“接力”转运。
统筹设计,构筑高效递药系统
在创新理论的基础上,团队也将视野延申到开发合适的高分子递药材料上,为规模化生产铺平道路。载体结构明确、无毒且能规模化生产是临床转化应用的关键。作为分子结构明确的单分散合成高分子,树状高分子是理想的递药载体。但传统树状高分子的合成基元反应效率低、副产物多,导致其纯化困难、单分散高分子产率极低,无法规模化应用。针对这一难题,团队提出了不对称单体对‘正交双点击反应’的树状高分子合成新方法,简化了合成步骤,提升了产率和合成效率,并显著提高了高分子结构的精准性。据了解,利用新方法,第五代树状高分子在一天之内就可以合成。
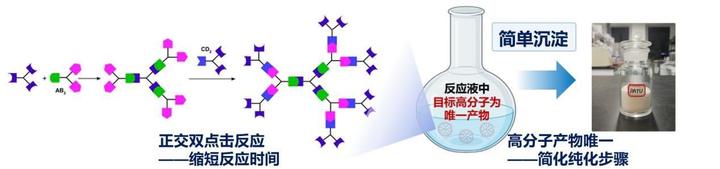
单分散高分子载体合成新方法
在新机制的指导下,团队还利用载体材料构筑起高效递药系统。为实现肿瘤靶向递药的疗效最大化,在解决了两大瓶颈难题后,团队还梳理出包括血液循环、血管外渗、瘤内渗透、细胞摄取和药物释放在内的五步级联过程,详细阐明了高分子载体尺寸、表面电势、稳定性等纳米特性与各步效率间的关系,揭示了各步对纳米特性的矛盾要求。并提出了通过载体性质自适应将递药系统各功能进行集成和协同的原则,建立起载体性质调控方法,实现了递药系统的功能集成。
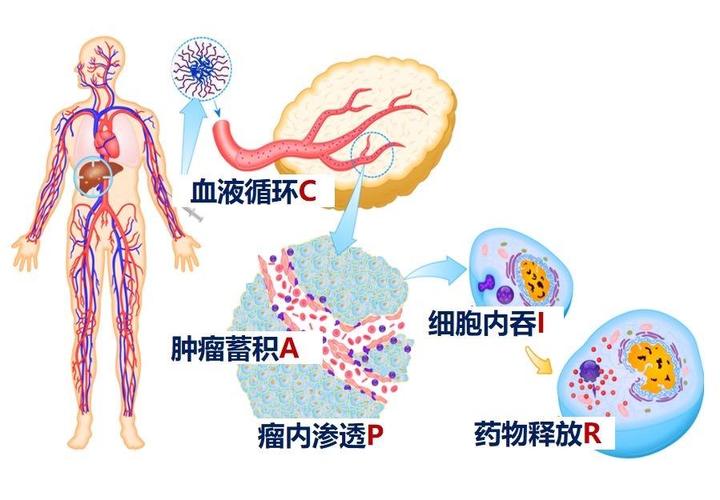
CAPIR五步级联过程
团队的创新性理论指导实现3项转化成果,其中1项已在美、韩开展临床试验并获得美国孤儿药授权,另2项分别获中、美临床试验批件,为胰腺癌、肺癌和大肠癌等癌症的治疗提供有力支持。

“我们团队将继续深入研究,进一步阐明高分子结构与转胞运能力之间的关系,发展功能集成型高分子精准合成方法,构建更高效的递药系统,为战胜癌症病魔提供有力武器。”申有青说。
(部分素材由项目团队提供)

来源: 潮新闻
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 浙江省科学技术协会
浙江省科学技术协会 
