出品:科普中国
作者:龚路遥(中国科学院微生物研究所)
监制:中国科普博览
编者按:为揭开科技工作的神秘面纱,科普中国前沿科技项目推出“我和我的研究”系列文章,邀请科学家亲自执笔,分享科研历程,打造科学世界。让我们跟随站在科技最前沿的探索者们,开启一段段充满热情、挑战与惊喜的旅程。
去年8月23日,我们团队——中国科学院微生物研究所向华团队,在国际期刊《自然·通讯》(Nature Communications)杂志上发表了题为《工程化最小I型 CRISPR-Cas 实现人类细胞的转录激活和碱基编辑》的最新研究成果,成功应用Class 1中最精简的I-F2型系统,在人类细胞中实现了高效基因调控,并开发了具有宽编辑窗口的碱基编辑工具。

论文DOI: 10.1038/s41467-024-51695-x
怎样理解这款基因编辑的新工具呢?它又将如何改变我们的生活?
基因编辑技术,就像一把“基因魔剪”
基因编辑作为近年来发展迅猛的颠覆性技术,具有广阔的应用前景,如修复遗传疾病的突变基因、提高农作物的产量和抗旱性等。
基因编辑技术是指对生命遗传物质(DNA)进行精确改造的技术。简单来说,它就像是给DNA做“剪切粘贴”的工具。
DNA是生物体内携带遗传信息的分子,它决定了生物的各种特征,比如眼睛的颜色、身高,甚至是某些疾病的易感性。想象一下,DNA就像是一本说明书,里面写着如何构建一个生物体的所有指令。基因编辑技术就是让我们能够阅读这本说明书,并且对其中的内容进行修改。
具体来说,基因编辑技术允许科学家们定位到DNA上的特定位置,然后进行精确的切割,就像是用剪刀剪掉说明书上的某一句话。接着,科学家们可以替换掉被剪掉的部分,或者添加一些新的内容,这就像是用胶水把新的句子粘到说明书上。
通过对指定的突变基因进行修复、对有害基因进行清除或对有益基因进行强化等,DNA的指令得到了修改,生物也从而获得了新的功能或表型。
最流行的“分子剪刀”,也并非完美
目前,最流行的基因编辑技术叫做CRISPR-Cas9,它就像是一把非常锋利的“分子剪刀”,可以快速、高效地对DNA进行编辑。
那么,CRISPR-Cas9为什么能够起到“分子剪刀”的作用呢?
CRISPR-Cas系统是广泛存在于细菌和古菌中的免疫系统,就像是它们身体里的“警察”,能够识别并“抓住”那些想要伤害它们的病毒。
而CRISPR-Cas9就像是这个免疫系统中的一个特别厉害的“警察”。它由两部分组成:一个是“向导”(引导RNA),另一个是“剪刀”(Cas9蛋白)。当病毒试图入侵细菌时,“向导”会先找到病毒的DNA(就像是病毒的“身份证”),然后“剪刀”就会剪断病毒的DNA,使病毒无法正常工作。
科学家们发现这个“警察”非常厉害,于是他们就利用这个原理,开发出了一种叫做CRISPR-Cas9的工具,用来编辑其他生物的基因。
首先,科学家们会设计一个“向导”,这个“向导”可以精确地找到我们想要编辑的DNA序列。然后,再使用“剪刀手”在那个位置上剪断DNA。接下来,细胞会尝试修复这个断裂的地方,而科学家们可以利用这个机会,把他们想要的基因片段添加进去,或者修改现有的基因。

基因编辑技术
(图片来源:veer图库)
CRISPR-Cas系统具有高效、特异、设计简单等显著优势,目前已被广泛应用于从细菌至哺乳动物等多种生物的基因编辑。
然而,即便是像CRISPR-Cas9工具这样流行的“分子剪刀”,也并非是完美的。传统的CRISPR-Cas系统在编辑过程中会切割靶标DNA双链,可能引起细胞损伤等风险。
碱基编辑技术:“剪刀”升级为“可擦笔”
为改进这一缺点,在传统的CRISPR-Cas系统基础上,衍生出了一种重要的碱基编辑技术。
碱基编辑技术就像是一支特殊的笔,它结合了切割功能受损的CRISPR-Cas和一种叫做脱氨酶的“墨水”。当“向导”找到需要修改的DNA位置时,神奇的“墨水”可以直接把那个位置的字母改成我们想要的字母,从而避免了剪断DNA双链可能会造成的损伤。
但是,这种特殊的笔也有它的限制。比如,它只能在一定范围内修改字母,这个范围就是“编辑窗口”。目前,科学家们正在努力让这支笔进化得更小巧、更精确,并且能够修改不同范围的字母。
此外,就像不同的纸可能需要不同的笔来书写一样,单一的基因编辑工具难以在不同的生物中发挥功能。科学家们也正致力于发现更多CRISPR-Cas类型,为多样化的基因编辑工具开发提供支持。
这也是我们团队(中国科学院微生物研究所向华团队)一直努力的方向。
新款基因编辑“瑞士军刀”问世
如前文所说,在细菌的免疫系统中,CRISPR-Cas系统种类多样,不只有CRISPR-Cas9这一个“警察”。
其中,I型CRISPR-Cas系统可以组合多种Cas蛋白形成复合物(Cascade)。Cascade可以与不同的功能元件组装,开发不同的衍生工具。基于这一系统开发的遗传工具,在细菌和古菌中表现出高效性与适应性,但较大的基因尺寸却不利于工具的递送,限制了其在哺乳动物细胞中的应用。
因此,我们团队近年来将目光聚焦到了I-F2型系统上,它具有最精简、基因尺寸最小的Cascade。但在此前,科学家一直未能在哺乳动物细胞中检测到它的活性。这也为我们团队的研发带来了挑战。
通过生物信息学分析,我们团队在数据库中找到93个不同菌种来源的I-F2型CRISPR-Cas系统。这极大地扩充了这类系统的基因资源,为其应用提供更多选择。其中,11个不同来源的I-F2型CRISPR-Cas系统被合成并在人类细胞中测试其功能。
最终,我们发现来自奥斯陆莫拉氏菌(Moraxella osloensis CCUG 350)的I-F2型系统在人类细胞中可以表现出较好的活性。它的Cascade仅由3种蛋白组成(Cas5-6-7),基因大小之和约2.7kb, 比目前应用最广的SpCas9(约4.1kb)还要小。
我们通过将I-F2型系统融合不同的功能元件,在人类细胞中实现了不同的功能,它就像一组“瑞士军刀”,虽然小巧,但非常好用:
1.多基因表达上调:在该系统的Cas7蛋白上融合转录激活因子VPR,我们获得了I-F2型转录激活工具(I-F2 CRISPRa),可实现多个基因的表达上调。这意味着,如果我们想让细胞多产生一些特定的蛋白质,可以用这个功能来实现。
2.靶标基因表达进一步提高:通过对引导RNA和Cas7的工程化改造,靶标基因的表达进一步提高,可以与SpCas9相当,甚至在某些位点效果更强。可以理解工具变得更加高效,可以产生更多特定的蛋白。
3.更宽的编辑窗口:在该系统的Cas5蛋白上融合表达腺嘌呤脱氨酶TadA-8e,我们获得了I-F2型腺嘌呤碱基编辑工具(I-F2 ABE),其编辑窗口覆盖约30个碱基(基于Cas9的碱基编辑工具窗口通常小于10个碱基),可以将编辑窗口内的腺嘌呤A变为鸟嘌呤G。I-F2 ABE产生的宽编辑窗口具有更多的可靶向位点,能诱导更多的突变类型。
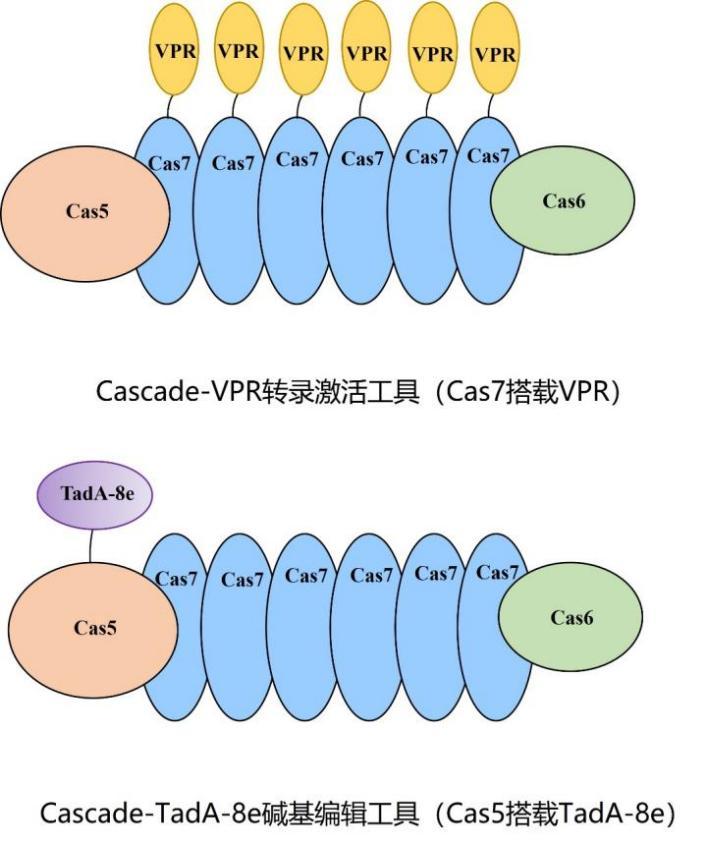
I-F2型底层平台构建新型转录激活及碱基编辑工具
(图片来源:作者自绘)
应用潜力巨大,有望开发更多新型工具
目前来看,这款新型的基因编辑工具,展示出了巨大的潜力:
1.利于真核细胞中递送:这项研究突出了精简的I-F2型系统在真核生物中的应用潜力,其小型化的基因组成利于基因编辑工具的体内递送。
2.适用于作物育种与改良:宽窗口的碱基编辑工具适用于功能序列的破坏、作物育种中重要基因的原位饱和诱变与多重碱基编辑等。
3.新型底层平台:I-F2型系统Cascade的多蛋白组成,使其便于融合多个功能元件,为开发更多新颖的基因操作工具提供底层平台。
这项研究突出了精简的I型系统在真核生物中的应用潜力,尤其是具有宽编辑窗口的碱基编辑工具。未来,对该系统进行全面的工程化改造,还有望进一步提高其编辑效率或转录激活水平。
参考文献:
1.Pacesa, M., Pelea, O. & Jinek, M. Past, present, and future of CRISPR genome editing technologies. Cell 187, 1076-1100, doi:10.1016/j.cell.2024.01.042 (2024).
2.路遥 & 向华. 2020 年度诺贝尔化学奖: 源自微生物学前沿研究的重大突破. 科学通报 65, 4171-4176, doi:10.1360/TB-2020-1416 (2020).
3.Komor, A. C., Kim, Y. B., Packer, M. S., Zuris, J. A. & Liu, D. R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420-424, doi:10.1038/nature17946 (2016).
4.Makarova, K. S. et al. Evolutionary classification of CRISPR-Cas systems: a burst of class 2 and derived variants. Nature Reviews Microbiology 18, 67-83, doi:10.1038/s41579-019-0299-x (2020).
5.Li, M. et al. Toxin-antitoxin RNA pairs safeguard CRISPR-Cas systems. Science 372, doi:10.1126/science.abe5601 (2021).
6.Xu, Z. et al. Native CRISPR-Cas-Mediated Genome Editing Enables Dissecting and Sensitizing Clinical Multidrug-Resistant P. aeruginosa. Cell Reports 29, 1707-1717 e1703, doi:10.1016/j.celrep.2019.10.006 (2019).
7.Cheng, F. et al. Harnessing the native type I-B CRISPR-Cas for genome editing in a polyploid archaeon. Journal of Genetics and Genomics 44, 541-548, doi:10.1016/j.jgg.2017.09.010 (2017).

来源: 中国科普博览
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 中国科普博览
中国科普博览 
