导读
近日,韩国科学技术院(KAIST)Sukbok Chang课题组报道了一种通用的铁与手性烯胺双重催化醛的对映选择性α-酰胺化反应(amidation)(高达>99:1 er)。基于实验和计算研究,作者提出了一种新型的反应机理,其中可见光促进LMCT(配体至金属的电荷转移)生成的[Fe(II)Cl3−]能够有效地活化二噁唑酮并生成铁-酰基类氮宾(iron-acylnitrenoid)自由基,其可插入手性烯胺中间体中。文章链接DOI:10.1021/jacs.4c07884
(图片来源:J. Am. Chem. Soc.)
正文
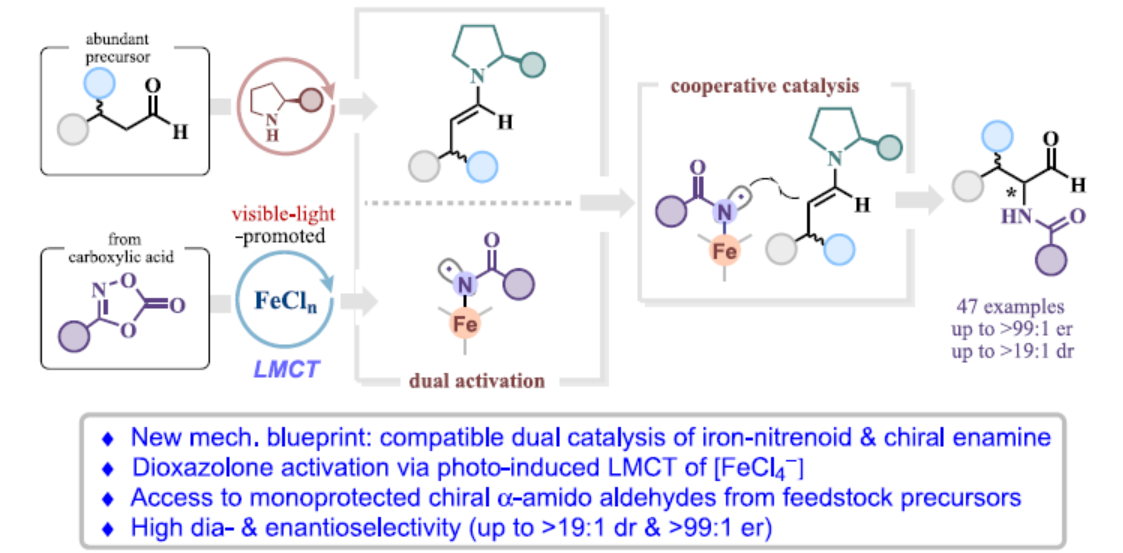
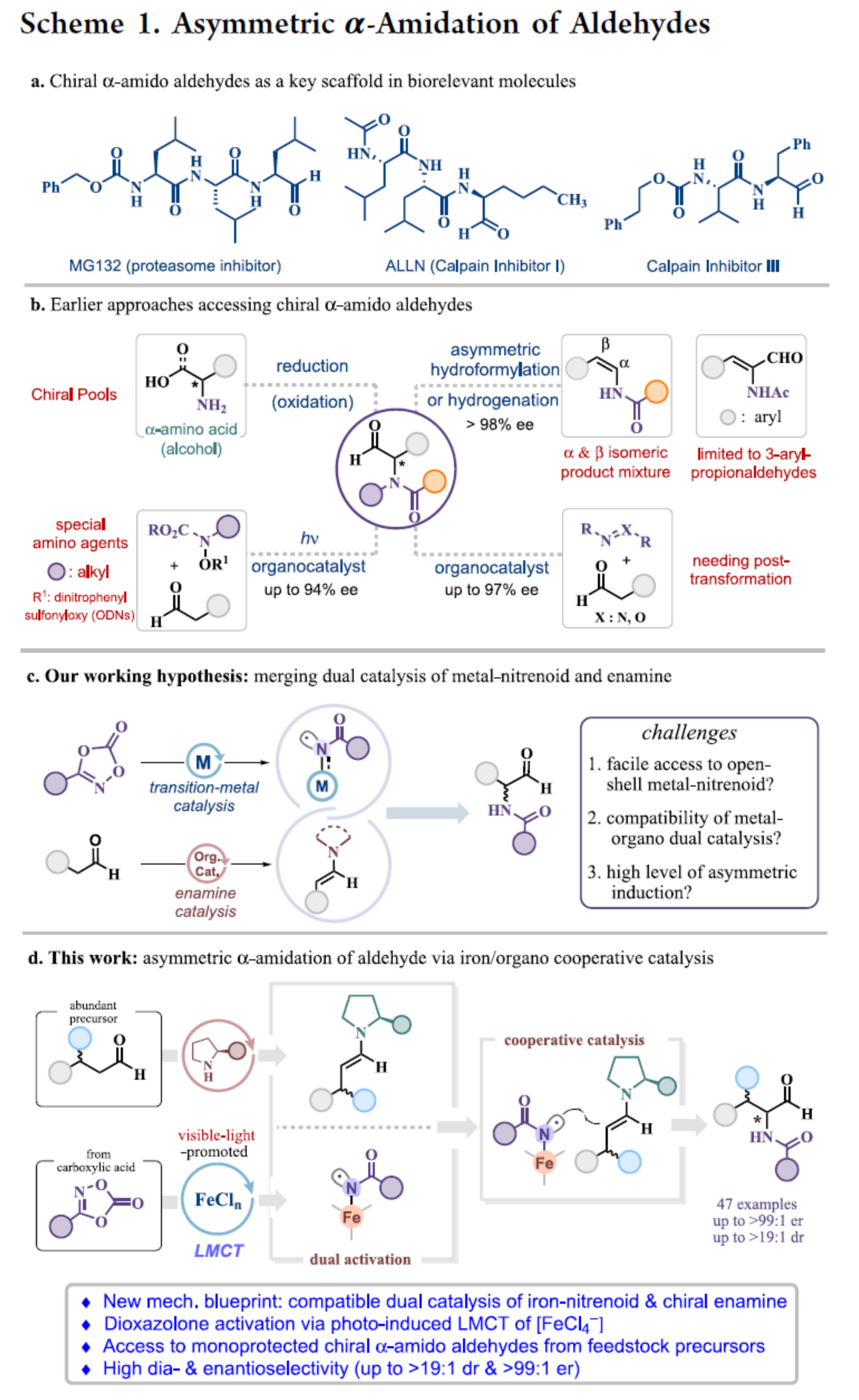
手性α-酰胺醛(amido aldehydes)是一类生物相关分子的关键结构单元(Scheme 1a)。同时,α-酰胺醛也是合成各种含氨基砌块的有价值的前体,包括非天然氨基酸、α-氨基酮或β-氨基醇。目前,化学家们已开发几种合成手性α-酰胺醛的方法(Scheme 1b)。当采用α-氨基酸或β-氨基醇作为手性前体时,传统的还原或氧化方法是有效的。同时,化学家们还开发了一些过渡金属催化的不对称烯烃转化,如铑催化α-甲酰基烯酰胺氢化和烯酰胺加氢甲酰化反应。2002年,List课题组(J. Am. Chem. Soc. 2002, 124, 5656.)和Jørgensen课题组(Angew. Chem. Int. Ed. 2002, 41, 1790.)分别报道了使用偶氮二羧酸盐作为氨基源,实现了脯氨酸催化醛对映选择性α-胺化的开创性实例。2013年,MacMillan课题组(J. Am. Chem. Soc. 2013, 135, 11521.)开发了一种基于有机催化光氧化还原的方法,可生成与手性烯胺反应的N-中心自由基。然而,该过程采用了一种特定的氨基源,其含有光不稳定二硝基苯磺酰氧基(ODNs)基团。Sukbok Chang课题组假设,金属催化二噁唑酮的活化可生成开壳金属-类氮宾化合物,其可与烯胺的反应性协同结合,从而实现醛的不对称α-酰胺化(Scheme 1c)。近日,韩国科学技术院Sukbok Chang课题组报道了一种新型的有机-铁双重催化策略,实现了可见光促进的醛与二噁唑酮的不对称α-酰胺化反应,具有优异的非对映选择性和对映选择性(Scheme 1d)。其中,铁配合物的配体到金属电荷转移(LMCT)对于生成类氮宾中间体至关重要。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
(图片来源:J. Am. Chem. Soc.)
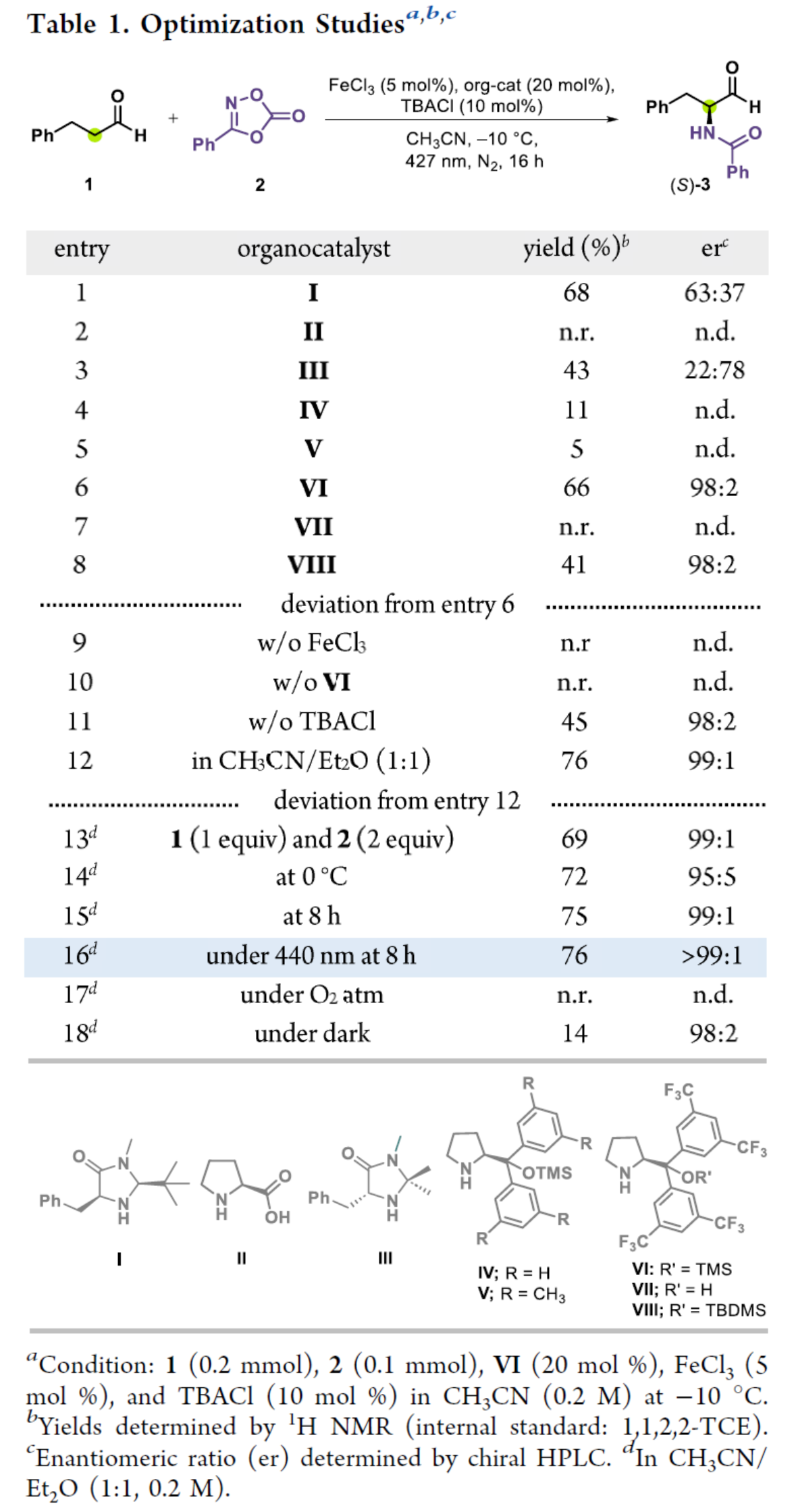
首先,作者以3-苯基丙醛1与3-苯基-1,4,2-二噁唑-5-酮2作为模型底物,进行了相关反应条件的筛选(Table 1)。当以(S)-VI(20 mol %)作为有机催化剂,FeCl3(5 mol %)作为金属催化剂,TBACl(10 mol %)作为添加剂,440 nm照射下,在CH3CN/Et2O(1:1)混合溶剂中-10 oC反应8 h,可以76%的收率得到产物(S)-3,er > 99:1。
(图片来源:J. Am. Chem. Soc.)
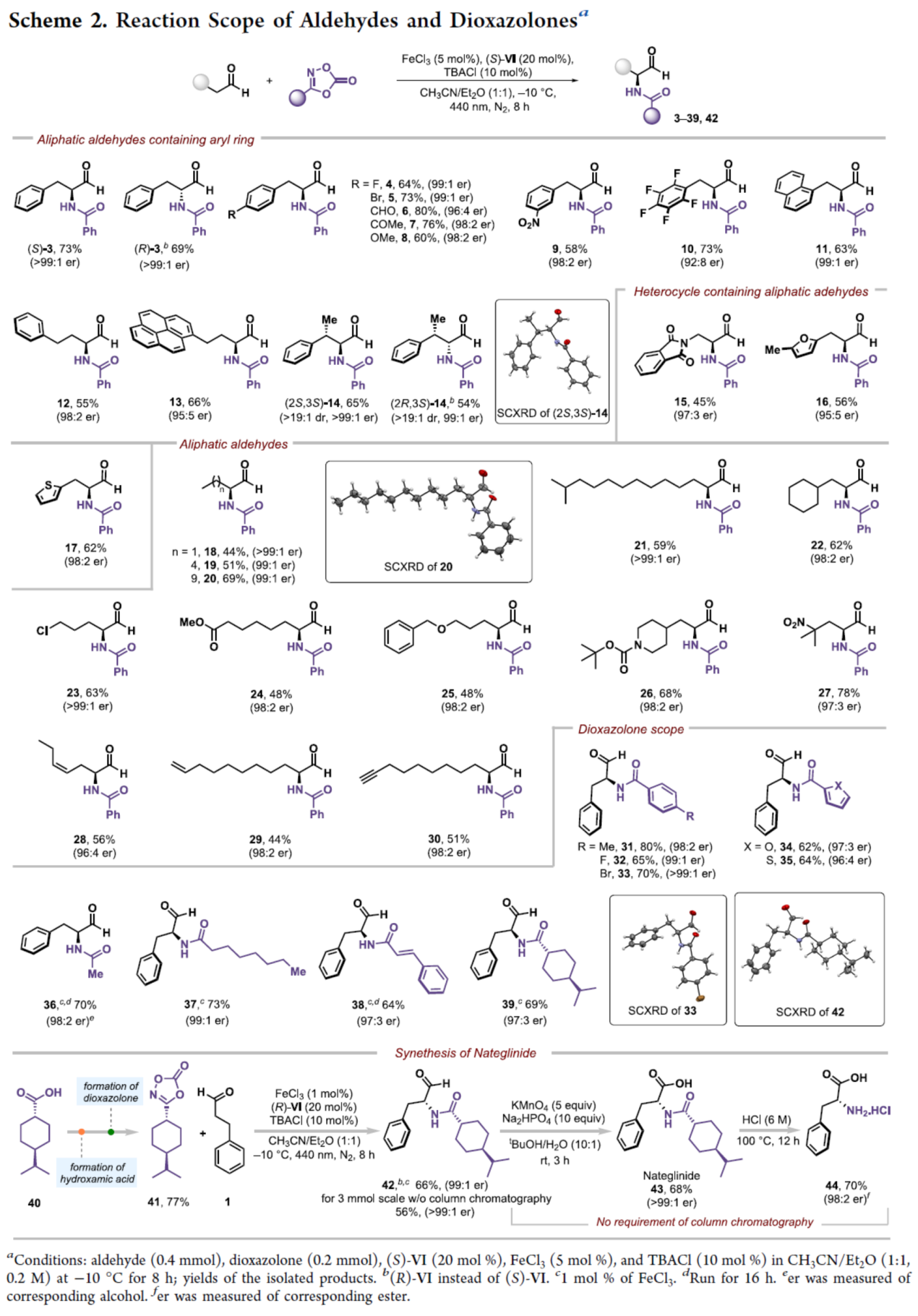
在获得上述最佳反应条件后,作者对醛和二噁唑酮底物范围进行了扩展(Scheme 2)。首先,一系列含有不同电性取代的芳基和杂环取代的脂肪醛,均可顺利进行反应,获得相应的产物3-17,收率为45-80%,er为92:8->99:1。其次,一系列直链或支链烷基取代的脂肪醛,也是合适的底物,获得相应的产物18-30,收率为44-78%,er为96:4->99:1。此外,一系列(杂)芳基二噁唑酮和烷基取代的二噁唑酮,也能够顺利进行反应,获得相应的产物31-39,收率为62-80%,er为96:4->99:1。值得注意的是,一系列活性的基团(如卤素、烷氧羰基、甲酰基、烯基、炔基等)均与体系兼容,进一步证明了反应具有出色的官能团兼容性。同时,以化合物41和1为底物,在上述的标准条件以及随后的氧化条件下,可以两步44%的总收率得到那格列奈(Nateglinide,43),这是一种治疗糖尿病的药物。然后,通过进一步的脱保护后,43可转化为氨基酸D-苯丙氨酸(44),收率为70%,er为98:2。值得注意的是,该过程无需进行色谱的分离。
(图片来源:J. Am. Chem. Soc.)
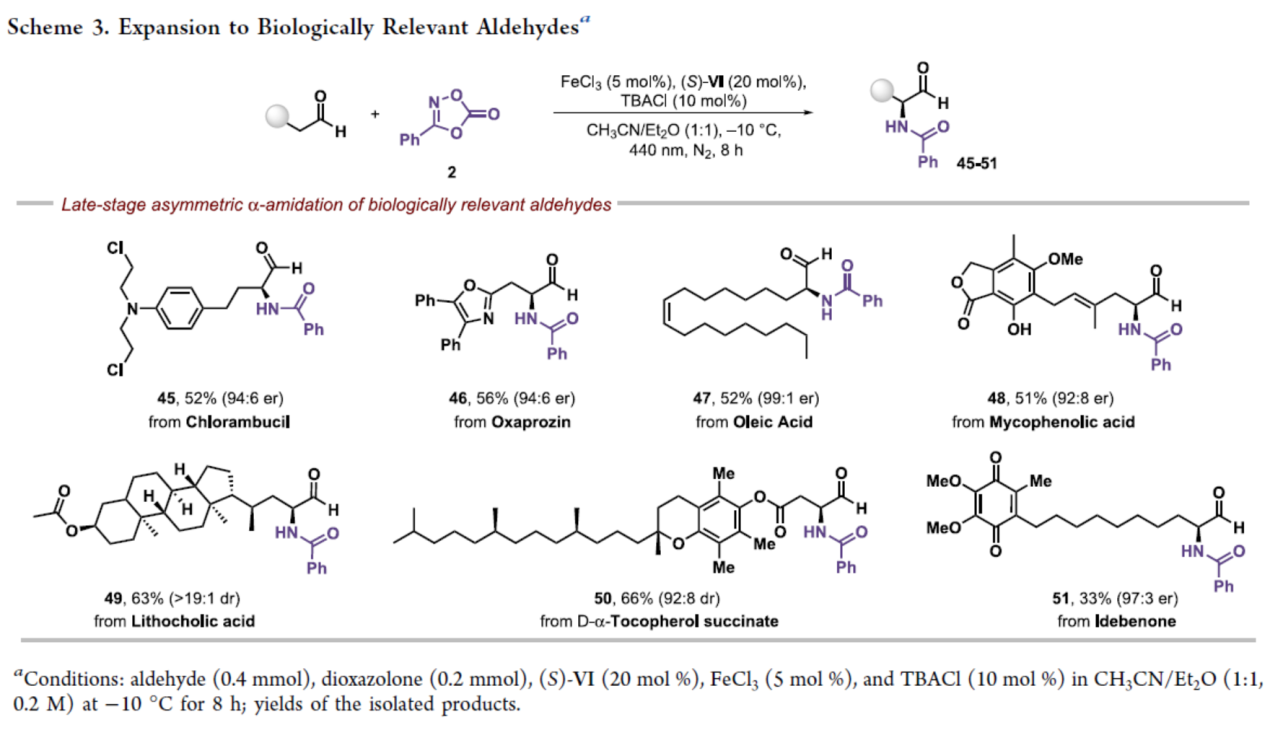
紧接着,该策略还可用于一些生物相关分子的后期衍生化,如苯丁酸氮芥(Chlorambucil)、奥沙普秦(Oxaprozin)、油酸(Oleic acid)、麦考酚酸(Mycophenolic acid)、石胆酸(Lithocholic acid)、D-α-生育酚琥珀酸酯(D-α-Tocopherol succinate)和艾地苯醌(Idebenone),获得相应的衍生物45-51,收率为33-63%,er为92:8-99:1(Scheme 3)。
(图片来源:J. Am. Chem. Soc.)
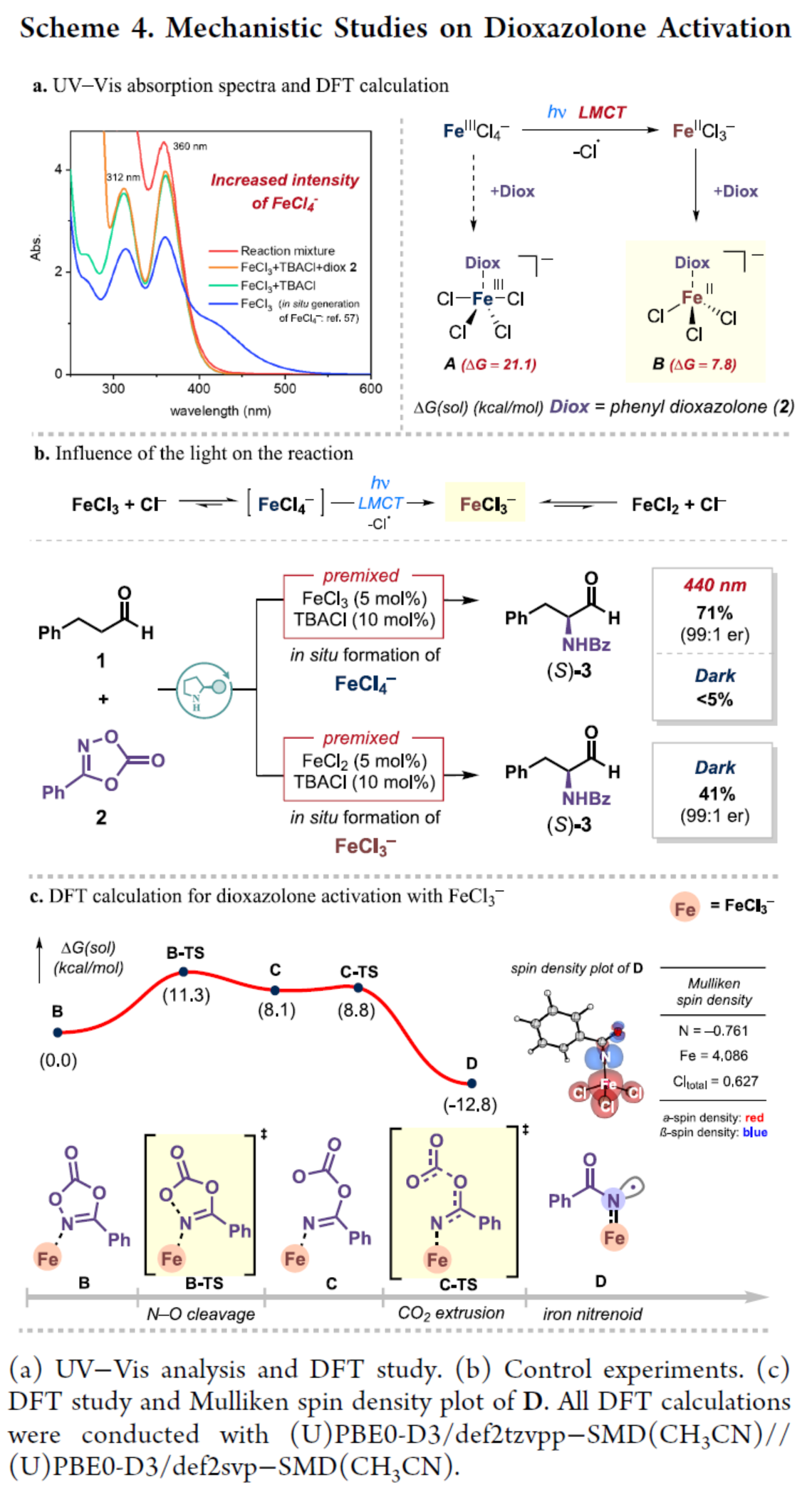
此外,作者还对反应机理进行了进一步的研究(Scheme 4)。首先,UV-Vis结果发现,FeCl3溶液在312 nm和360 nm附近显示出特征峰,对应于FeCl4−,可能是由FeCl3前体通过与CH3CN中FeCl2+的平衡产生的。添加TBACl添加剂后,无论是否存在二噁唑酮2,FeCl4−的这些峰的强度都会增加(Scheme 4a)。DFT研究结果表明,尽管FeCl4−是在标准条件下原位形成的,但FeCl4−与二噁唑啉酮的直接结合导致其活化是具有挑战性的。或者,FeCl4−的LMCT在光照下会产生FeCl3−,并且该物种将在结合时负责二噁唑酮的活化。控制实验结果表明,FeCl3−是通过FeCl4−的LMCT形成的,在上述的反应条件下,FeCl3−主要活化二噁唑酮(Scheme 4b)。进一步的DFT计算结果表明,二噁唑酮2中的N−O键断裂非常容易被FeCl3−破坏,随后释放CO2也很容易。生成的铁-类氮宾D是放热的。同时,铁-类氮宾D是高自旋的Fe(III)-亚氨基自由基(Scheme 4c)。
(图片来源:J. Am. Chem. Soc.)
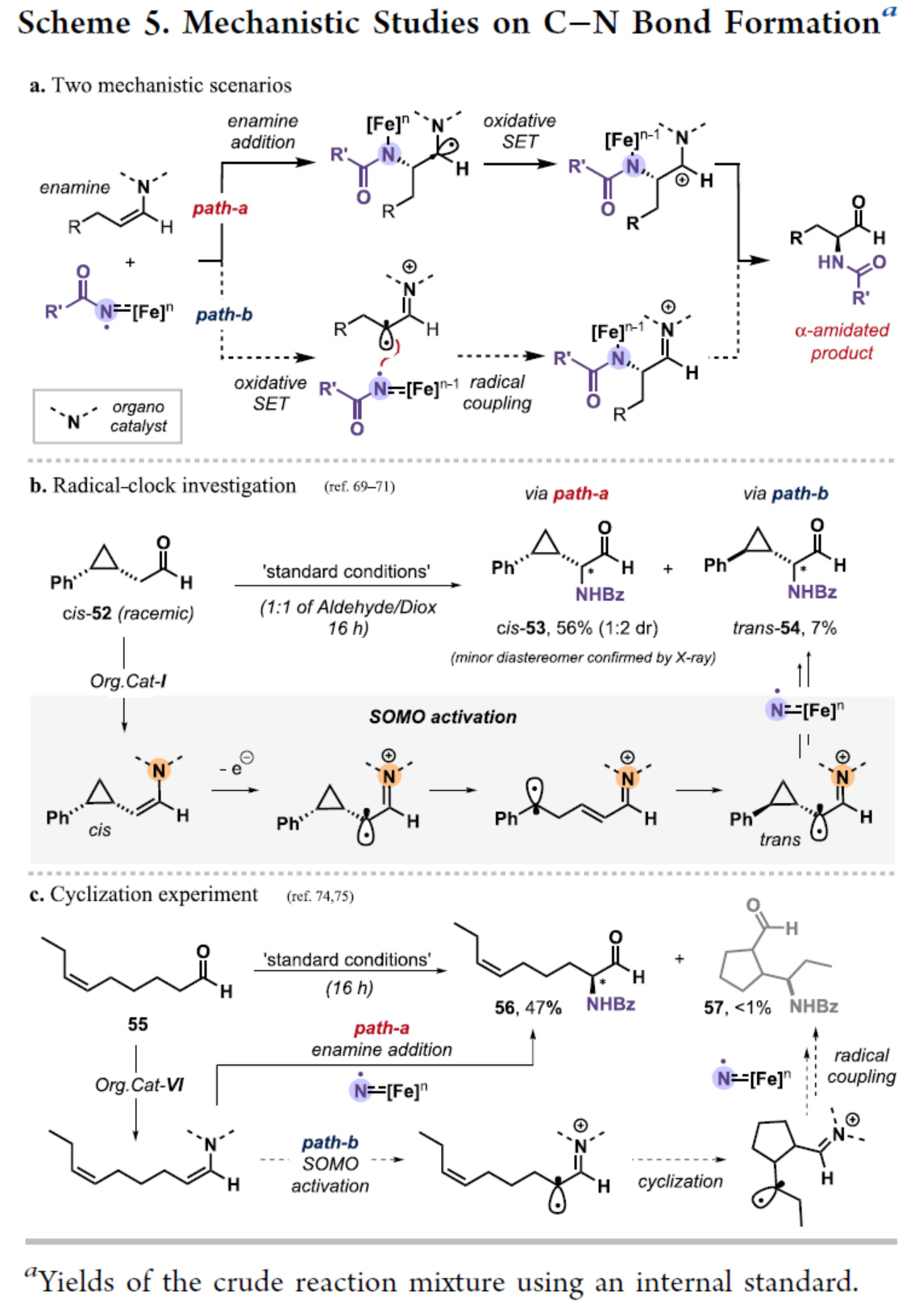
基于上述的研究以及相关文献的查阅,作者提出了两种合理C-N键的形成的过程(Scheme 5)。在Path a中,烯胺加成到亚胺基(imidyl)自由基上,然后进行氧化1e转移(SET)。在Path b中,烯胺的氧化SET,称为单占据分子轨道(SOMO)活化,以及亚胺基自由基和碳自由基(carboradical)之间的自由基偶联(Scheme 5a)。同时,相关的自由基钟实验结果表明,虽然C-N形成的两种途径都是合理的,但烯胺直接加成到亚胺基(imidyl)自由基的过程更占主导地位(Scheme 5b)。其次,环化对照实验结果也进一步支持了烯胺加成途径更为合理,但也不能完全排除SOMO过程(Scheme 5c)。
(图片来源:J. Am. Chem. Soc.)
总结
韩国科学技术院Sukbok Chang课题组报道了一种铁与有机小分子双重催化醛的对映选择性α-酰胺化反应(高达>99:1 er)。机理研究表明,通过可见光促进的LMCT原位生成的[Fe(II)Cl3−]能够有效地活化二噁唑酮,并生成了铁-酰基类氮宾自由基,随后插入手性烯胺中间体。鉴于其出色的不对称诱导作用,这种方便的醛不对称α-酰胺化反应将具有广泛的合成应用。
来源: 化学加


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 化学加
化学加 
