出品:科普中国
作者:杨昌佳涟(中国科学院微生物研究所)
监制:中国科普博览
编者按:为解码生命科学最新奥秘,科普中国前沿科技项目推出“生命新知”系列文章,从独特的视角,解读生命现象,揭示生物奥秘。让我们深入生命世界,探索无限可能。
基因编辑,这个出现在高中课本中的名词,它的原理简单易懂:通过核酸内切酶实现对基因组特定基因序列的敲除、插入或精确修饰。近期科学家们又找到了一把能够打开基因编辑世界大门的钥匙:RNA指导的重组酶。这个工具不仅有可能改变基因编辑的“游戏规则”,还可能为我们未来的生物技术带来惊人的突破。
RNA的神秘力量:基因编辑的“超级英雄”
基因组编辑就像是在编写一本巨大的生命手册,而RNA就是那位巧妙的编写者。传统的基因编辑工具,如CRISPR-Cas9(一种基因编辑工具,通过RNA引导的Cas9酶精确地切割DNA),就像是一把锋利的剪刀,可以精确地剪切特定的DNA序列。然而,RNA指导的重组酶则是更进一步的“超级英雄”,它们不仅可以剪切,还能插入、倒位或删除更长的DNA序列——这就像是能操控整个生命篇章的魔法师。
2024年6月,一项研究揭示了RNA指导的重组酶的新特性,这些酶可以通过一种称为“桥RNA”(bRNA)的特殊工具,在基因组的指定位置精确地插入或删除DNA序列。bRNA像是这些重组酶的GPS导航系统,指引它们到达特定的“目的地”。
想象一下,这些重组酶就像是一群受过专业培训的修理工,而bRNA则是他们的图纸和指南,确保每个修补工作都能准确无误地完成。
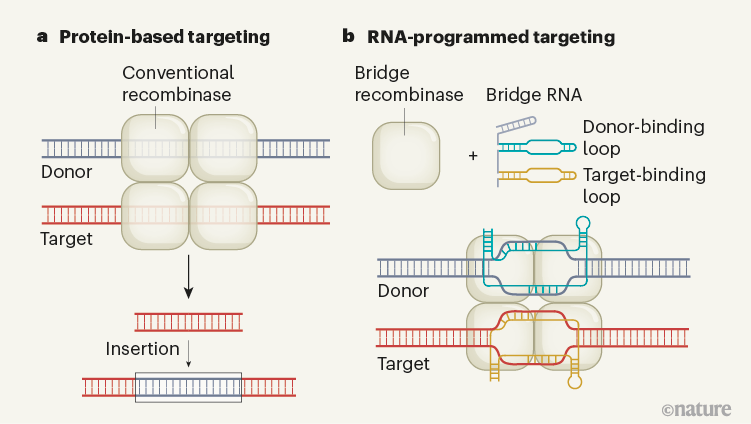
常规酶和桥式重组酶的比较
(图片来源:参考文献1)
新的发现:探险家的伟大旅程
科学家的每一次研究就像是一场激动人心的探险旅程,他们发现IS110元件(一类短的移动遗传元件,可以在细菌基因组中移动,通过插入基因或调控区域,引起基因突变、失活或调控改变)不仅编码重组酶,还携带了一种非编码RNA,即桥RNA(bRNA),这一发现犹如在荒野中找到了一张通往宝藏的地图。
bRNA通过两个独立的环结构来实现其功能:供体结合环(DBL)识别供体DNA,而靶点结合环(TBL)则识别靶点DNA。这种双环结构使得bRNA可以精确地指导重组酶在基因组中进行各种操作,如插入、倒位或删除DNA序列。
更令人兴奋的是,这些环结构可以独立设计,赋予重组酶前所未有的灵活性。这就像是给了探险家们一套万能工具,无论面对何种地形,他们都能找到通往目标的最佳路径。此外,他们还通过计算识别了其他IS110和IS1111元件中的bRNA,这意味着这种工具不仅限于一种重组酶,而是一个庞大的家族,各具特色,潜力无穷。
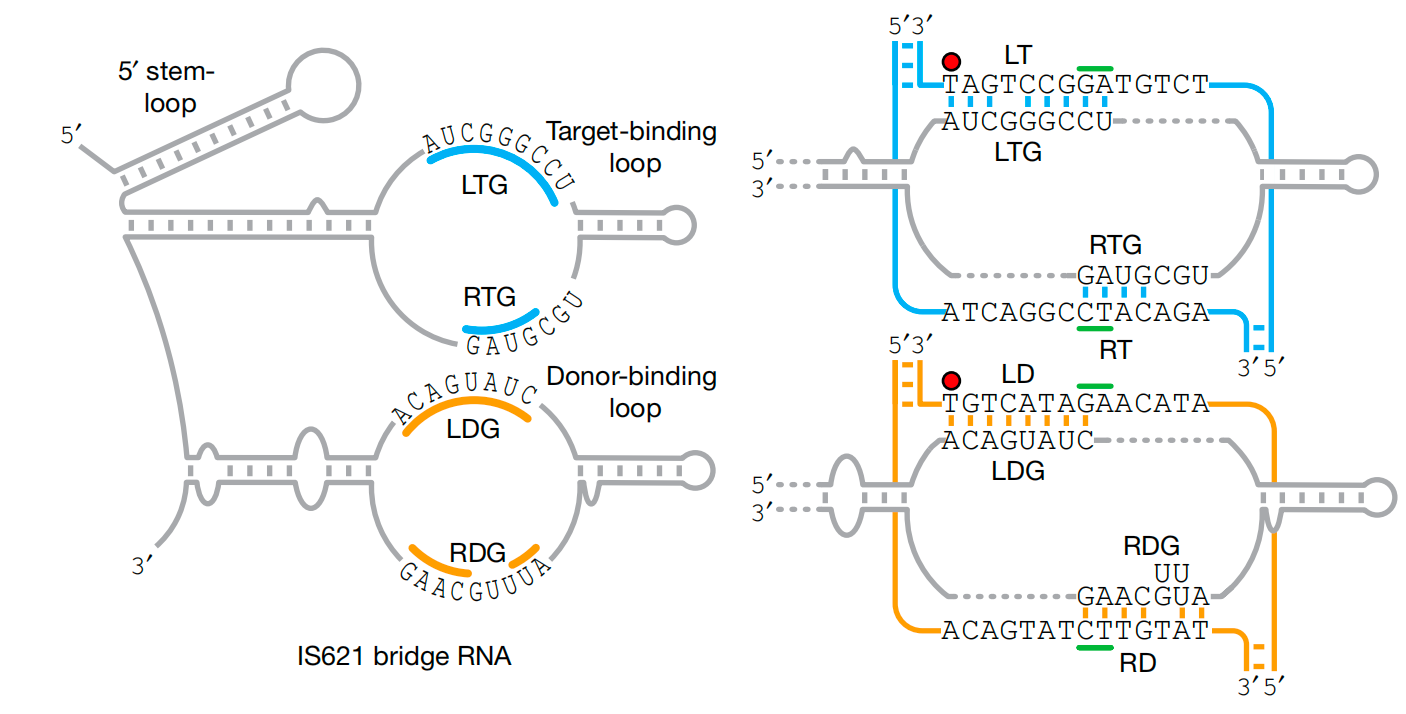
左:bRNA的结构图,右:bRNA与同源靶和供体DNA的碱基配对模型
(图片来源:参考文献5)
DNA的神奇舞蹈:从分子到大工程
为了搞清楚这些重组酶和bRNA如何协同工作,科学家们进行了详细的结构研究。就像是给我们展示了一场分子级别的芭蕾舞表演,科学家们通过高分辨率结构解析揭示了这些酶在DNA重排反应中的动作细节。
在这个舞蹈中,DBL(供体结合环)和TBL(靶点结合环)是舞者的两只脚,分别负责与dDNA(供体DNA)和tDNA(靶点DNA)配对。而重组酶的活性位点就像是舞台上的焦点,负责执行精准的剪切动作。
研究还揭示了重组酶中的疏水氨基酸如何使DNA双链不稳定(不稳定指的是DNA双链的结构变得不够紧密或稳定,可能导致双链部分的解开或局部的变性),从而帮助bRNA识别目标。科学家们甚至比喻说,这些氨基酸就像是让舞台上的灯光闪烁,让重组酶的动作更加迷人和准确。
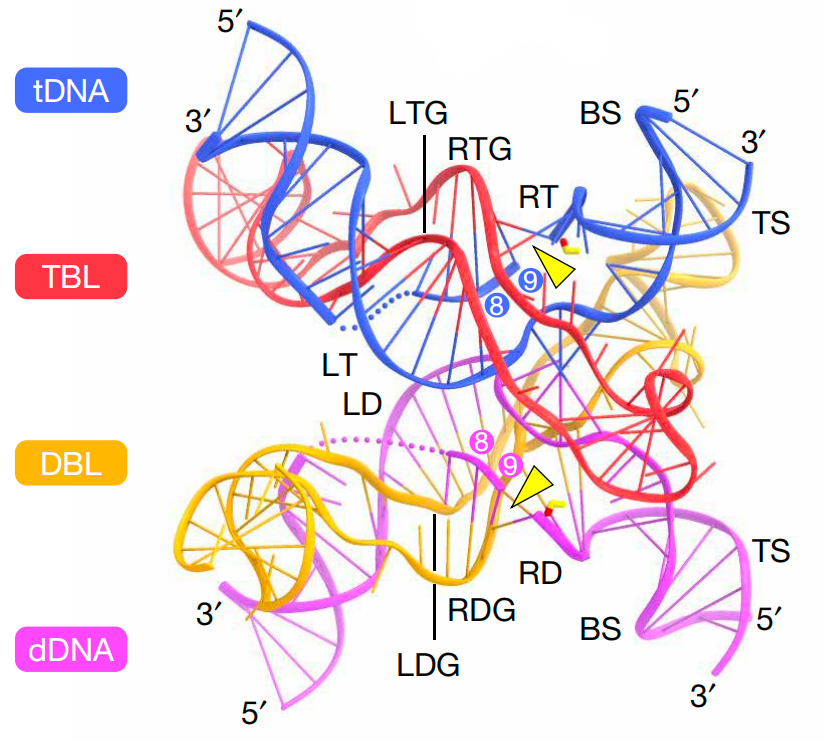
bRNA-dDNA-tDNA复合物的结构
(图片来源:参考文献3)
挑战与希望:从实验室到现实
尽管这些研究成果令人振奋,但当前的研究主要集中在体外实验和大肠杆菌中,像是在一个受控的实验室舞台上进行排练。我们还不确定这些可编程的重组酶能否在其他更复杂的生物体中发挥同样的作用。
不过,科学家们对这些RNA指导的重组酶的应用充满期待。想象一下,如果我们能够在哺乳动物细胞中实现同样的精确基因编辑,这将为医学研究和治疗带来怎样的变革?正如CRISPR-Cas系统在多种生物体中展现了它的强大功能,我们有理由相信,经过进一步的优化和工程改造,RNA指导的重组酶也能在更复杂的生物系统中大显身手,在哺乳动物细胞中展现它们的威力。
结语
RNA指导的重组酶为基因组编辑开辟了新的篇章。这些工具不仅提高了编辑的效率和特异性,还展示了令人惊叹的精准度和灵活性。这些研究不仅为基因组编辑领域带来了令人激动的新进展,还激励了科学家们继续探索其他RNA的可编程功能。让我们拭目以待,期待发现更多有趣的生物工具,填补基础生物学与强大生物技术工具之间的空白。
参考文献:
1. Connor J. Tou & Benjamin P. Kleinstiver. Programmable RNA-guided enzymes for next-generation genome editing.
2. Durrant, M.G., Perry, N.T., Pai, J.J. et al. Bridge RNAs direct programmable recombination of target and donor DNA. Nature 630, 984–993 (2024).
3. Hiraizumi, M., Perry, N.T., Durrant, M.G. et al. Structural mechanism of bridge RNA-guided recombination. Nature 630, 994–1002(2024).

来源: 中国科普博览
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 中国科普博览
中国科普博览 
