
前言概述
/ CONTENTS
学科新知聚焦业内权威专家,从学科发展的高度全面梳理、深入解读肿瘤医学各领域的国内外研究现状与进展,为医护以及科研人员立体勾勒恶性肿瘤领域的最新研究进展,赋能临床科研和学术推广,为医学研究者搭建一个共享知识、交流经验的平台,推动肿瘤医学领域的国际化合作与发展。
本期学科新知分享的是中南大学湘雅二医院彭宏凌教授对B细胞非霍奇金氏淋巴瘤学科发展的精彩解读。
淋巴瘤种类繁多、分类复杂,长期以来一直是病理诊断与临床治疗工作的难点。随着新型分子检测与诊断技术的出现和推广应用,新的淋巴瘤分类标准以及关键的淋巴瘤分子分型极大促进了淋巴瘤的精准诊断、风险分层、预后评估以及精准治疗。
1
淋巴瘤的流行病学及临床分期
淋巴瘤是中国最常见的恶性肿瘤之一。国家癌症中心发布的2022年中国恶性肿瘤疾病负担情况数据显示,2022年中国新发淋巴瘤8.52万例,其中男性4.81万例,女性3.71万例;死亡4.16万例,其中男性2.51万例,女性1.65万例[1]。非霍奇金淋巴瘤包括淋巴组织的多种恶性肿瘤,可来源于B细胞(85~90%)、T细胞或NK细胞的克隆扩增。在我国,NHL约占淋巴瘤的90%,其中B细胞NHL约占75%,T/NK细胞来源的NHL约占25%。B细胞淋巴瘤又可以分为前体B细胞肿瘤和成熟B细胞肿瘤。成熟B细胞淋巴瘤根据组织分型的不同可分为多种类型,常见的有弥漫大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)等[2-4]。
淋巴瘤的临床分期目前采用Ann Arbor-Cotswolds分期系统,2014版Lugano分期标准对Ann Arbor-Cotswolds分期进行了改良。此外,一些特殊类型的淋巴瘤,如慢性淋巴细胞白血病、皮肤蕈样霉菌病和Sézary综合征、原发结外鼻型NK/T细胞淋巴瘤和原发中枢淋巴瘤等,有其专属的分期系统。
2
淋巴瘤规范诊疗
淋巴瘤的诊断应当结合患者临床表现、体格检查、实验室检查、影像学检查和病理学检查结果等进行诊断。
淋巴瘤的治疗取决于具体的分型和分期。非霍奇金淋巴瘤主要采用免疫化疗及靶向治疗。化疗药物通常会组合使用,其中最常见的为CHOP方案(环磷酰胺+柔红霉素+长春新碱+强的松)。医生也会在化疗基础上联合利妥昔单抗,组成临床上应用最广的R-CHOP方案。
可用于非霍奇金淋巴瘤免疫治疗的单抗类药物有CD20单抗、CD52单抗、CD30单抗、CD79b单抗,最常用的免疫检查点抑制剂为帕博利珠单抗。此外,免疫调节剂如沙利度胺、来那度胺等也可通过影响免疫系统,加强抗癌效果。CAR-T免疫疗法的出现,则使淋巴瘤的治疗迈上一个新的台阶。
非霍奇金淋巴瘤的靶向治疗领域中,常用的药物分为蛋白酶体抑制剂、组蛋白去乙酰化酶抑制剂、激酶抑制剂(如BTK抑制剂和PI3K抑制剂)。
对于复发的非霍奇金淋巴瘤患者,可采用大剂量化疗后行干细胞移植重建骨髓进行治疗,移植的干细胞可来自患者自身或直系亲属[5]。
对于惰性B细胞非霍奇金淋巴瘤(B-iNHL)而言,通常先采取密切观察,待发现病情进展后再行治疗。然而,B-iNHL具有病程长、易反复的特点。同时,部分患者会发生高级别转化。因此,对此类患者的风险分层和个体化治疗仍然是重要的研究方向。
3
淋巴瘤治疗的探索之路
淋巴瘤对药物治疗敏感,在细胞毒性药物治疗的基础上,近年来随着小分子靶向药物(例如PI3K抑制剂、BTK抑制剂、核输出蛋白抑制剂、BCL2抑制剂等)、新靶点单抗药物(如CCR4单抗)、抗体偶联药物(如CD79b、CD30抗体偶联MMAE)、双特异性抗体(如CD3-CD20双抗)和细胞治疗(CAR-T和CAR-NK)的进展,淋巴瘤患者的预后持续改善。
在弥漫大B细胞淋巴瘤中,通过精准靶向治疗进一步提升DLBCL的治愈率仍是当前重要的研究方向。2023年ASCO、EHA和ICML会议都报告了POLARIX研究老年亚组结果,Pola-R-CHP组降低了36%进展或死亡风险[6]。2023年EHA会议报道,纳入CD20+且IPI≥3分的初治DLBCL接受6周期的Epcoritamab与R-CHOP联合治疗后单药Epcoritamab维持治疗至1年,客观缓解率(ORR)100%,6周期诱导治疗后的完全代谢缓解(CMR)84%,19例完成1年维持治疗的患者,仍有95%(18/19)的患者保持CMR状态[7]。2023年ASH会议报道,在一线患者中,Glofit-Pola-R-CHP方案最佳ORR和CMR率分别为100%和91.7%,12个月PFS和OS率分别为87.5%和91.7%[8]。
作为中国抗癌协会血液肿瘤专业委员会委员,中南大学湘雅二医院血液内科彭宏凌主任带领团队锐意进取,在正在举办的2024EHA大会上展现中国智慧。一项“Significance Study of PET/CT Imaging Evaluation in Mucosa-Associated Lymphoid Tissue Lymphoma”的研究[9]探究了基线18F-FDG PET/CT在黏膜相关淋巴组织淋巴瘤(MALT)中是否具有预后意义,并结合临床特征,探讨该疾病的预后预测因素。研究共收集80例MALT患者的临床数据和基线18F-FDG PET/CT的半定量指标,包括SUVmax、MTV及TLG。对患者进行随访,获得PFS和OS。MALT患者的中位年龄为55(19~83)岁。与复发进展相关的不良预后指标包括年龄(≥60岁)、Ann Arbor分期(Ⅲ/Ⅳ)、IPI评分(>2)、B症状、幽门螺杆菌感染、血红蛋白(≤120 g/L)、血清白蛋白(≤35 g/L)、血清β2-MG(>3 mg/L)。此外,复发进展和死亡患者的TLG和MTV均显著高于未复发进展和未死亡患者(P<0.05)。根据受试者工作特征曲线(ROC),在2~208个月随访期内,以复发进展作为状态变量,确定TLG和MTV的临界值(cut-off值)分别为620.10(AUC=0.723)和42.10(AUC=0.726)是预测最佳值,大于该值提示与复发进展风险相关性大。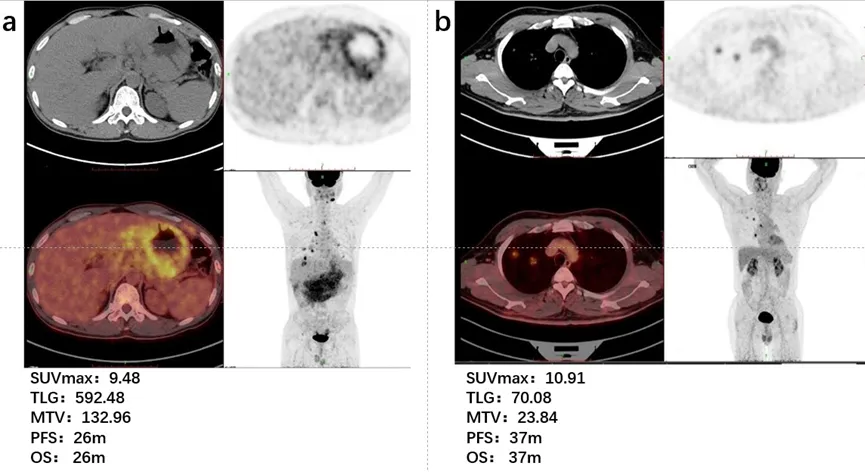
图1 不同代谢性肿瘤负荷的MALT淋巴瘤患者个案在PET/CT扫描中的代表性图像:
(a)胃壁浸润、多处淋巴结、双侧肺部、胸膜、盆底筋膜和气管上段管壁浸润的患者;(b)肺部受累和淋巴结浸润的患者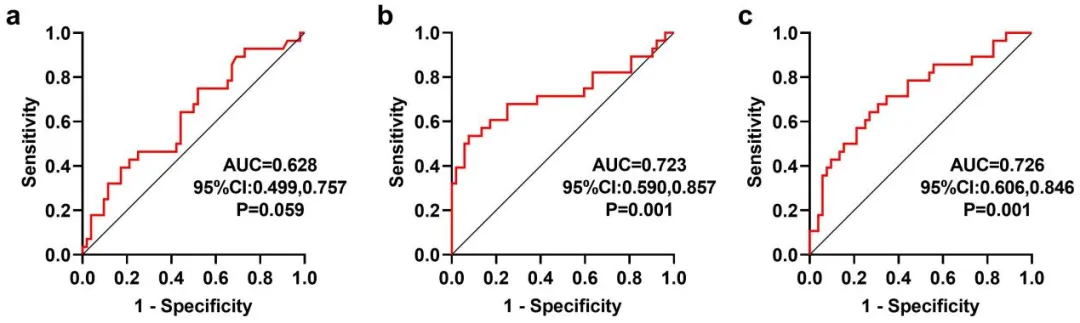
图2 PET/CT指标的ROC曲线:(a)SUVmax;(b)TLG;(c)MTV
生存分析显示,MALT的中位PFS为36(1~144)个月,中位OS为40(3~208)个月。单变量分析显示年龄(≥60岁)、Ann Arbor分期(Ⅲ/Ⅳ)、IPI评分(>2)、B症状、幽门螺杆菌感染、白细胞(<4或>10×109 /L)、血红蛋白(≤120 g/L)、血小板(<100或>350×109 /L)、血清β2-MG(>3 mg/L)、TLG(≥620.10)(HR:0.21;95% CI:0.10~0.44;P<0.001)、MTV(≥42.10)(HR:0.33;95% CI:0.15~0.73;P=0.004)与PFS不良预后之间存在相关性。将其纳入多变量分析后,证实Ann Arbor分期是独立预后因素。此外,单变量生存分析提示Ann Arbor分期(Ⅲ/Ⅳ期)、B症状、血红蛋白(≤120 g/L)、血小板(<100或>350×109 /L)、血清β2-MG(>3 mg/L)以及TLG(≥620.10)(HR:0.16;95% CI:0.05~0.50;P<0.001)与OS不良预后显著相关。然而,进一步的多变量分析表明这些因素并不独立影响OS。
图3 MALT淋巴瘤患者PFS的单变量生存分析:(a)年龄;(b)Ann Arbor分期;(c)IPI评分;(d)B症状;(e)幽门螺杆菌感染;(f)白细胞水平下降/升高;(g)血红蛋白水平下降;(h)血小板水平下降/升高;(i)血清白蛋白水平下降;(j)血清β2-微球蛋白水平升高;(k)TLG水平升高;(l)MTV水平升高
基线18F-FDG PET/CT中代谢指标TLG和MTV是预测MALT患者是否复发进展和死亡的预后因素,协同临床特征与生存结局结合,有助于全面分析MALT的治疗疗效和预后因素参考价值,判别更精准、更细化。
4
淋巴瘤学科发展趋势与对策
中国淋巴瘤的诊断和治疗相关研究在近年来取得了许多成果,中国研究者的研究也在国内外期刊、大会上进行了报告,中国淋巴瘤研究能力和国际影响力不断扩大。为进一步提高中国淋巴瘤诊疗水平,未来需要加强淋巴瘤病理专科医生的培养和淋巴瘤指南的推广和宣传,推动指南进校园及下基层活动。坚持以循证医学证据为指导,加强开展MDT诊疗活动为患者选择规范个体化的治疗方案;积极开展更多淋巴瘤的基础和转化研究;深入了解淋巴瘤的发生发展机制,寻找新的治疗靶点,特别是在靶向治疗、免疫治疗和细胞治疗领域开展更多的高质量临床协作研究。中国患者绝对数大,我们应该依托中国淋巴瘤人群多开展原创性临床研究,为中国淋巴瘤患者的个体化治疗提供理论和实践基础。
淋巴瘤病理分型复杂,且病理类型的分布比例在中国和西方国家具有差别,因此,在未来淋巴瘤的基础和转化研究中,需要聚焦于中国高发的淋巴瘤类型,建立适合中国患者的分子分型体系;紧扣淋巴瘤细胞生物学行为,发现治疗耐药的新靶点;针对淋巴瘤致病关键信号通路,应用靶向治疗新策略,积极开展更多高质量、高水平、具有改变治疗指南作用的淋巴瘤基础和转化研究,以提高中国淋巴瘤的研究和诊治水平,改善中国淋巴瘤患者的治疗效果。随着二代测序等分子检测技术的进步,伴随着多基因组学技术的整合,研究成果应转化为不断优化的诊治手段和方法,为提高淋巴瘤患者生存带来契机;因此,积极开展更多高质量、高水平、具有临床意义的淋巴瘤基础和转化研究,明确免疫、靶向治疗等新的治疗方法的意义,客观、科学地评价其临床中的真实价值,就显得尤为重要。
参考文献(向上滑动阅览)
[1]Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024;4(1):page. DOI: 10.1016/j.jncc.2024.01.006.
[2]NCCN Guidelines Version 1.2020:B-cell Lymphomas.
[3]Thandra KC, Barsouk A, Saginala K, Padala SA, Barsouk A, Rawla P. Epidemiology of Non-Hodgkin's Lymphoma. Med Sci (Basel). 2021;9(1):5. Published 2021 Jan 30. doi:10.3390/medsci9010005
[4]Esau D. Viral Causes of Lymphoma: The History of Epstein-Barr Virus and Human T-Lymphotropic Virus 1. Virology (Auckl). 2017;8:1178122X17731772. Published 2017 Sep 25. doi:10.1177/1178122X17731772
[5]中国医疗保健国际交流促进会肿瘤内科学分会,中国抗癌协会淋巴瘤专业委员会,中国医师协会肿瘤医师分会.中国淋巴瘤治疗指南(2023年版)[J].中国肿瘤临床与康复,2023,30(1):2-39.DOI:10.13455/j.cnki.cjcor.113494-20230118-0032.
[6]Bei Hu et al., Subgroup analysis of elderly patients (pts) with diffuse large B-cell lymphoma (DLBCL) in the phase 3 POLARIX study.. JCO 41, 7518-7518(2023).DOI:10.1200/JCO.2023.41.16_suppl.7518.
[7] Anna Sureda, Lorenzo Falchi, Sirpa Leppa, et al; Epcoritamab With Rituximab + Lenalidomide (R2) Provides Durable Responses In Patients With High-Risk Follicular Lymphoma, Regardless Of Pod24 Status. 2023 EHA. Abstract: S222
[8]Max S. Topp, Monica Tani, et al; Glofitamab Plus R-CHOP Induces High Response Rates with a Manageable Safety Profile in Patients with Previously Untreated Diffuse Large B-Cell Lymphoma (DLBCL): A 12-Month Analysis from a Phase Ib Study. Blood 2023; 142 (Supplement 1): 3085. doi: https://doi.org/10.1182/blood-2023-174081.
[9]Qingyang Zhang, Le Yin, Wenzhe Yan, Xinyu Lu, Yunhua Wang, Hongling Peng. Significance Study of PET/CT Imaging Evaluation in Mucosa-Associated Lymphoid Tissue Lymphoma. EHA.2024.P2048.
来源: CACA前沿


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 乐问医学
乐问医学 