肺癌是最常见的癌症之一,也是世界上存活率最低的癌症之一。细胞因子是一种小型蛋白信号,已被证明可有效增强抗肿瘤效果。其中,白细胞介素-12(IL-12),作为细胞介导免疫的有效诱导剂,具有刺激活化 T 细胞和 NKT 细胞的效应功能,在肺癌等实体瘤中显示出良好的抗肿瘤作用。但由于它的脱靶毒性和给药方式的低效性,其应用受到限制。
IL-12 的应用到多方面因素的限制
1. 递送的 mRNA 表达短暂,需要频繁给药
目前 IL-12 的递送方法,主要是将 IL-12 mRNA 封装在脂质纳米颗粒(LNPs),然后向肿瘤递送。但传统 mRNA 递送后表达短暂,因此不得不提高给药频率。改为递送自复制 mRNA 可以弥补传统 mRNA 表达短暂的不足并降低给药频率,但也面临几个挑战,包括由于其分子量大导致表达不稳定,体内递送效率低,以及由于与碱基修饰的兼容性差而导致相对较高的免疫原性。
2. 肿瘤组织的低 pH 值和缺氧等特性或影响递送的 mRNA 表达水平
可能由于肿瘤组织的低 pH 值和缺氧等特性,LNPs 在肿瘤组织中递送的 mRNA 表达水平较低。此外,不同癌症类型的肿瘤细胞特性各异,因此可能需要针对不同癌症类型定制 LNPs,以优化肿瘤组织中的 RNA 转染效率,从而提高抗肿瘤疗效。
3. IL-12 全身给药可导致脱靶毒性
目前,给药 IL-12 的最佳方式似乎包括连续 5 天静脉输注或 2 周皮下注射。但频繁全身给药和皮下给药 IL-12,已被证实可产生剂量依赖性不良事件。
近日,针对以上问题,多伦多大学李博文团队提出了新的解决办法,并发表在Advanced Materials杂志上。他们筛选出针对肺癌的 H1L1A1B3 可电离脂质,将其整合进脂质纳米颗粒(LNPs)。然后利用这些纳米颗粒包封核酸,但包封的是 IL-12 circRNA,而不是 IL-12 mRNA。接着将给药方式由以往的多次静脉注射全身给药,改为单次瘤内注射和气管内给药,将 IL-12 circRNA 有效递送到肺部肿瘤,并联合免疫检查点抑制剂治疗(ICI),最终提高了肺癌免疫治疗的效果。
这项研究不仅为肺癌开创了一种新的基于 circRNA 的免疫疗法,而且还引入了一种针对特定癌症类型定制 LNP 的个性化方案。
这种创新的、定制化的免疫疗法,效果如何?
1. 定制 H1L1A1B3 LNPs 可将 RNA 转染效率提高 4 倍,并主动激活先天免疫通路
研究人员采用组合化学来筛选可电离脂质,并将 H1L1A1B3 筛选为 Lewis 肺癌细胞中有效递送 IL-12 circRNA 的可电离脂质候选物。当 H1L1A1B3 被整合进脂质纳米颗粒(LNPs)后,H1L1A1B3 LNPs 在 LLC1 肺癌细胞系中展现了 circRNA 转染效率的显著提升。这一效率是辉瑞/拜恩泰科公司 COVID-19 mRNA 疫苗中所使用的行业标准 LNP ALC-0315 的四倍。
研究还发现,空载的 H1L1A1B3 LNPs 能显著诱导 NF-κB 活化并触发 IRF 通路,先天免疫系统可通过这两种途径诱导I型干扰素(IFN)和细胞因子(TNF-α)的产生。这些结果表明,H1L1A1B31 是一种双功能脂质,能够促进有效的 circRNA 递送,并主动刺激先天免疫通路激活。
2. 包裹在 H1L1A1B3 LNPs 中的 IL-12 circRNA 降解延迟,在体外和体内产生更持久的RNA表达
通过连续 7 天收集 IL-12 circRNA 和 IL-12 mRNA 处理的肺癌细胞系的上清液发现,与 IL-12 mRNA 的表达相比,IL-12 circRNA 表现出明显的降解延迟。以肌肉注射的方式给药小鼠,观察到的结果与体外实验结果一致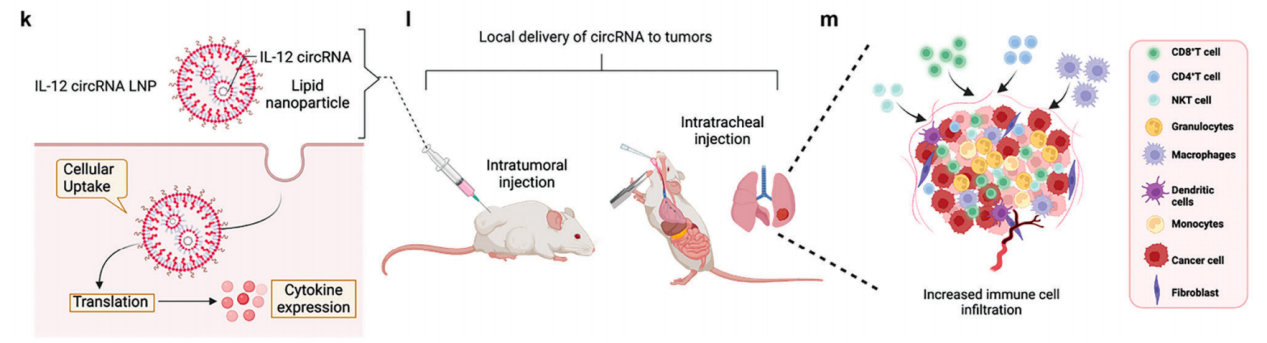
IL-12 circRNA 和 H1L1A1B3 LNPs 的制备和表征。k) IL-12 circRNA LNP 在肿瘤细胞中的传递和翻译过程。l)在两种小鼠肿瘤模型中应用两种不同的给药途径。m) IL-12 circRNA 重塑肿瘤微环境和肿瘤免疫治疗的机制。
这些结果表明,在相同情况下,circRNA 在体内的表达窗口大于 mRNA 的表达窗口,这有助于诱导持续的体液免疫反应。这些数据表明,包裹在 H1L1A1B3 LNPs 中的 IL-12 circRNA 能够在体外和体内产生持续的 circRNA 表达。
3. 通过瘤内注射 IL-12 circRNA LNPs 改进 Lewis 肺癌免疫疗法
基于以上研究结果,研究人员试图评估含有定制脂质配方和 IL-12 circRNA 有效载荷的非病毒基因递送系统在肺癌模型中的治疗潜力。为了减轻与全身给药相关的脱靶毒性,研究人员探索了肿瘤内给药对肿瘤免疫治疗有效性的影响。结果发现,单次瘤内给药 IL-12 circRNA LNPs 也足以延缓肿瘤进展,与 ICI(抗PD- 1)联合治疗则显示出诱导肿瘤强劲消退的能力。
具体而言,与治疗组相比,未治疗组的肿瘤组织增殖迅速,对体重的影响显著。而与 ICI 单药治疗组相比,IL-12 circRNA LNPs 联合 ICI 治疗组的小鼠没有因肿瘤生长而出现明显的体重减轻或体重增加。因此,研究人员推测,在未治疗组和治疗组之间观察到的巨大体重差异受到两组之间肿瘤进展率差异的影响。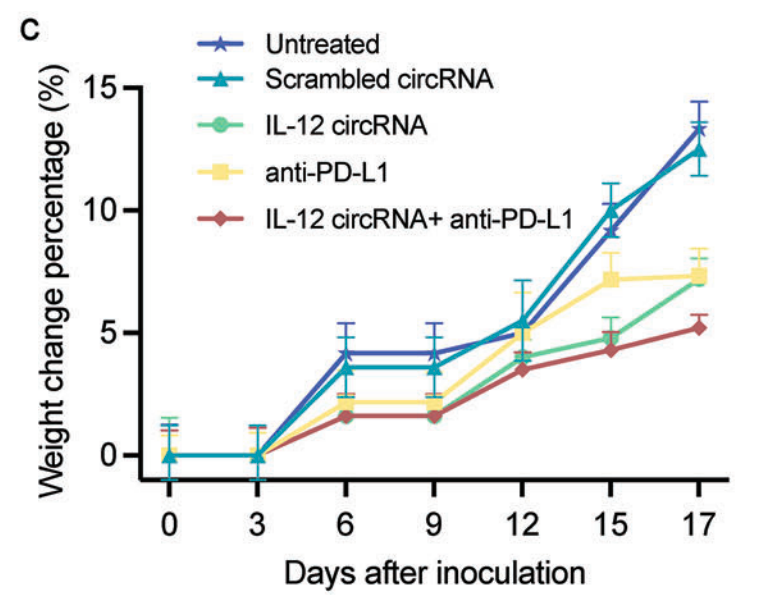
肿瘤接种后小鼠体重随时间的变化
4. IL-12 circRNA LNPs 的气管内给药抑制 NSCLC 进展
为了探索可行的肿瘤免疫治疗的替代给药途径,研究人员在非小细胞肺癌(NSCLC)临床前模型中采用气管内给药。通过 BLI 监测治疗前后的肿瘤生长,发现,未经治疗的小鼠肺肿瘤持续生长,而 IL-12 circRNA 处理的小鼠肺肿瘤负荷显著降低。
具体而言,研究人员通过尾静脉将荧光素酶标记的肺癌细胞株注射到小鼠体内,利用小动物活体光学成像(IVIS)在固定时间点观察和统计肺部肿瘤的生长。IVIS 结果显示 IL-12 circRNA 处理组的荧光量随治疗时间推移逐渐降低,经医学统计分析发现,与为治疗组相比,IL-12 circRNA 处理组治疗后的肿瘤负荷显著降低。结果如下图所示。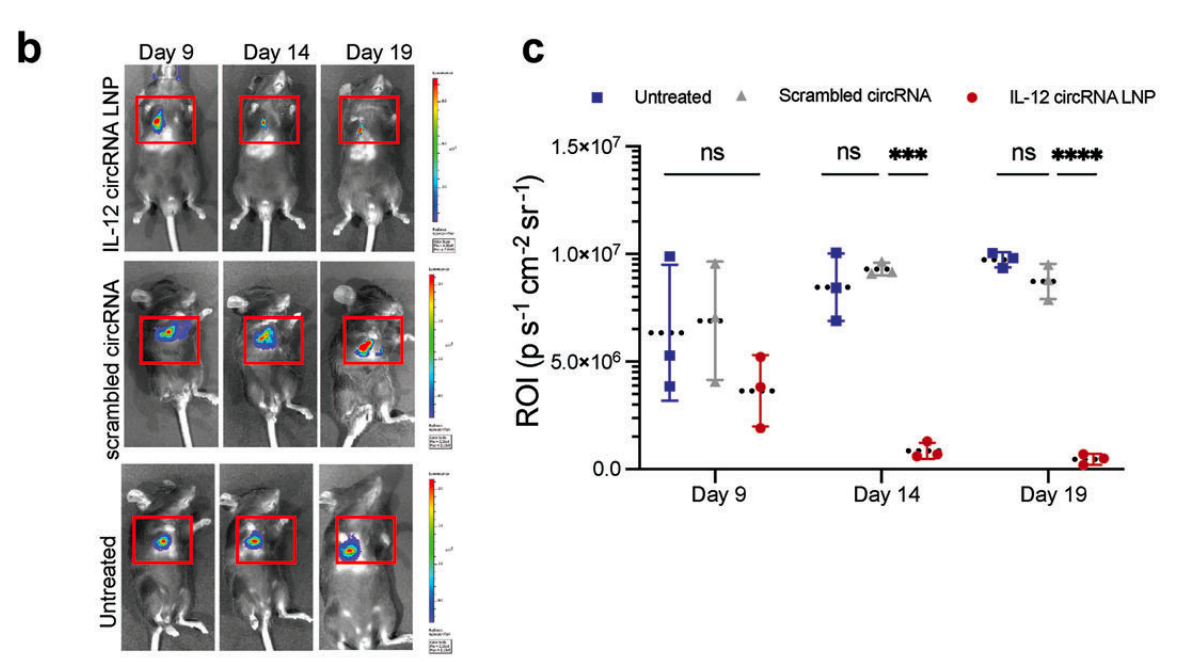
b 图为未治疗组和 IL-12 circRNA LNP 处理组小鼠的IVIS图像,c 图为未治疗组和 IL-12 circRNA LNP 处理组小鼠中荧光素酶信号的量化
研究人员还通过肺 H&E 染色量化切片中肿瘤组织面积的百分比,进而在组织学上量化肿瘤负荷,结果发现,与未治疗组相比,IL-12 circRNA 处理组治疗后的肿瘤面积显著降低。结果如下图所示。
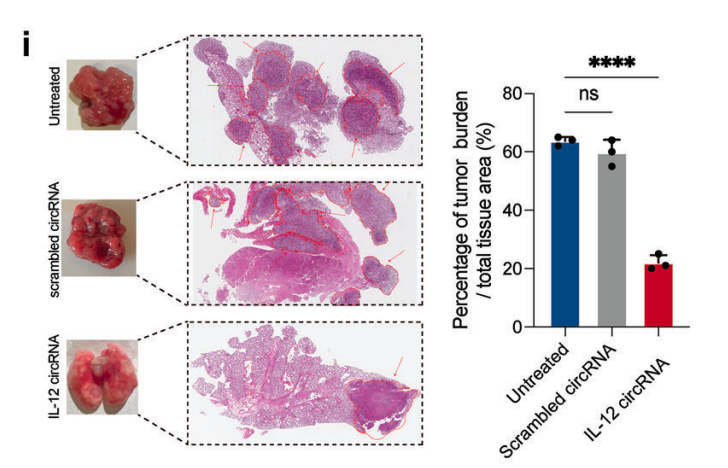
小鼠安乐死后肺部组织的H&E染色图和肿瘤组织面积差异的量化图
研究结果还表明,IL-12 circRNA 介导的肿瘤免疫治疗在肺癌模型中产生了显著水平的细胞因子(主要是 IFN-γ ),从而证实了 IL-12 在临床前模型中作为抗肿瘤免疫诱导剂的有效性。此外,T 细胞和 NKT 细胞释放的 IFN-γ 介导了肿瘤微环境(TME)内有利的免疫表型,这对抗肿瘤疗效至关重要。这些结果表明,IL-12 circRNA LNP 通过气管可有效控制肺癌的生长。
结语
IL-12 通过调节肿瘤微环境,进一步增强肿瘤免疫原性,而有策略地应用免疫刺激脂质纳米颗粒和联合使用免疫检查点抑制剂等,可进一步提高 IL-12 的抗肿瘤效果。
多伦多大学李博文团队开发了一种新的 LNP 递送策略,可以有效地将细胞因子编码 circRNA 递送到肿瘤。这种新的递送策略通过直接对癌症部位给药进行免疫治疗,为目前的肺癌免疫治疗带来了新希望。总的来说,该研究结果表明,作为肺癌患者潜在的新的免疫疗法,这种递送系统值得进一步开发。
参考文献:
[1]S. Xu,Y. Xu,N. C. Solek,J. Chen,F. Gong,A. J. Varley,A. Golubovic,A. Pan,S. Dong,G. Zheng,B. Li,Tumor-Tailored Ionizable Lipid Nanoparticles Facilitate IL-12 Circular RNA Delivery for Enhanced Lung Cancer Immunotherapy.Adv. Mater.2024, 2400307.https://doi.org/10.1002/adma.202400307IF: 29.4 Q1
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
