距离首次发现阿尔兹海默症(Alzheimer’s disease,AD)已过去百年时光,人们仍未发现能够彻底治疗 AD 的有效药物,究其原因,AD 的发病机制十分复杂难以被解析。AD 发病机制假说中最为经典之一是 Aβ 淀粉样蛋白致病假说,然而过去多年来人们基于该假说设计针对 Aβ 的药物却都收效甚微,近年来最为有名的药物应该是 Biogen 公司推出 aducanumab(阿杜那单抗),然而注射该药物的患者有 40% 都出现脑肿胀等可怕副作用。
2022 年 7 月全球最权威的学术期刊Science发表了一篇历时 6 个月的调查报告,报告称美国神经科学家 Sylvain Lesné 发表的学术论文存在造假行为,其中就包括其于 2006 年发表在Nature期刊上奠定了 Aβ 淀粉样蛋白致病假说的论文。这一报道揭开了误导学界十数年的真相,但也使得研发治疗 AD 药物的前景变得更为扑朔迷离。越来越多的科学家和药企将目光投向了 Aβ 以外的地方,如基因调控、能量代谢、脂质体或胶质细胞等。通过基因组学研究,人们发现 APP、PSEN1 和 PSEN2 这 3 个基因突变会导致早发性常染色体显性遗传性阿尔茨海默病(early-onset autosomal dominant Alzheimer's disease,ADAD),唐氏综合征患者中 APP 基因的三倍体出现会导致唐氏综合征相关阿尔兹海默症(Down syndrome-associated Alzheimer's disease,DSAD)的发生,且有其它多达数十种基因(如 ICA1L、LIME1、SIGLEC11、GRN 和 TMEM106B 等)则与散发(迟发)性 AD 风险增加有关[1,2]。
在这些众多基因突变中,APOE4 基因被视为与 AD 发病最相关的风险基因。携带两条 APOE4 等位基因(APOE4 纯合)的人在 85 岁左右罹患 AD 的概率高达 60%,远远高于只携带一条 APOE4 等位基因(APOE4 杂合)或不携带该基因的人。然而,尚未有研究通过 APOE4 来预测发病年龄,同样也尚未有研究将 APOE4 纯合和杂合分开去研究其与 AD 相关生物标志物的关系。
近日,来自西班牙巴塞罗那圣保罗医院 Víctor Montal 研究团队在Nature Medicine期刊上发表了题为APOE4 homozygozity represents a distinct genetic form of Alzheimer’s disease的研究论文,研究团队提出应当把 APOE4 视为 AD 的致病基因,而不单单只是风险基因,APOE4 纯合完全满足由基因确定的 AD(genetically determined AD,通常为家族性遗传)的三大特征:近乎完全的疾病外显率(即几乎一定会罹患 AD),可预测症状发病年龄,和病理特征/生物标志物/临床表现变化的可预测性。改变对 APOE4 的定义不但有助于提前发现这类 AD 患者并提早进行干预,同时也会给临床药物开发提供全新的思考方向。

研究团队结合了由美国国家阿尔兹海默症协调中心(NACC)提供的>3200 份 AD 患者病理样本,和由 5 个已发表大型多中心 AD 生物标志物研究队列提供的>10000 名志愿者的数据,对 APOE4 相关的临床、病理特征和生物标志物变化等内容进行了研究。
从疾病外显性来看,几乎所有的 APOE4 纯合者都表现出了更高的 AD 神经病理学评分,而中高以上的评分在 APOE3 纯合者中仅有 50%。APOE4 者纯合从 55 岁开始,生物标志物的水平就一直明显高于 APOE3 者纯合。到 65 岁时几乎所有 APOE4 者纯合都显现出了脑脊液中 Aβ1-42 的异常,且有 75% 出现了淀粉样蛋白沉积的扫描症状。到 80 岁时,生物标志物的外显率高达 88%(图1)。
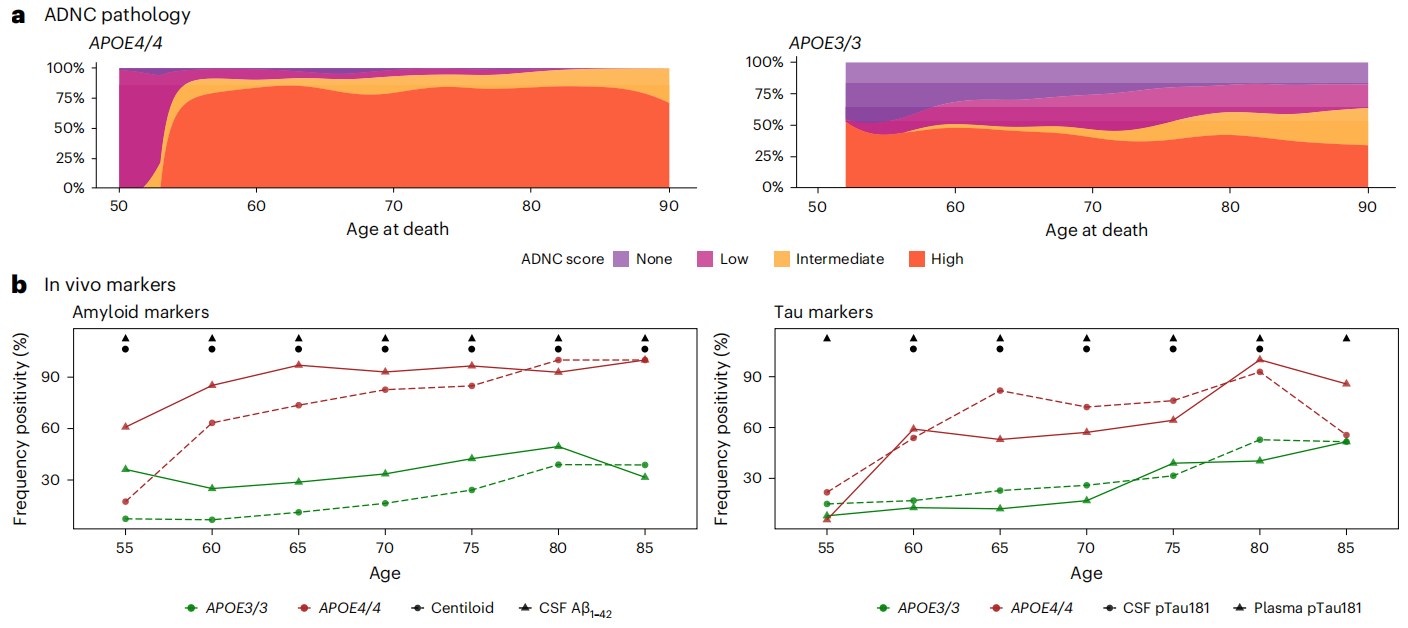
图1 APOE4 纯合者病理特征变化
从疾病进程来看,APOE4 纯合者约在 65.6 岁时出现 AD 症状,71.8 岁时出现轻度认知障碍,73.6 岁时彻底痴呆,最终在 77.2岁时死亡。这些时间点相较于 APOE3 纯合者提前了 7-10 年。这说明了 APOE4 会提高 AD 的患病风险和加速 AD 的疾病进程(图2)。
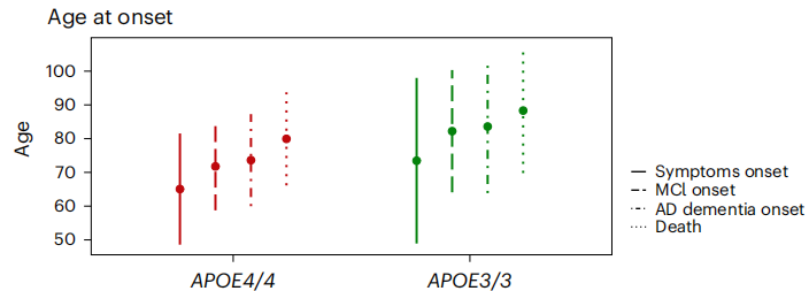
图2 APOE4 纯合者病理进程变化
从生物标志物变化来看,以 65.6 岁为 APOE4 纯合者的发病年龄,早在这之前 10-15 年,APOE4 纯合者脑脊液和血浆中的生物标志物,如 p-Tau 和 NfL 就已经相较于 APOE3 纯合者有了显著上升。此外通过 PET 对已确诊 AD 患者进行扫描分析发现,几乎所有携带了 APOE4 等位基因的患者有淀粉样蛋白沉积,而在 APOE3 纯合者中仅有 50% 是 PET 淀粉样蛋白阳性。在时间上,APOE4 纯合者的生物标志物变化也与 ADAD、DSAD 患者存在相似性(图3)。
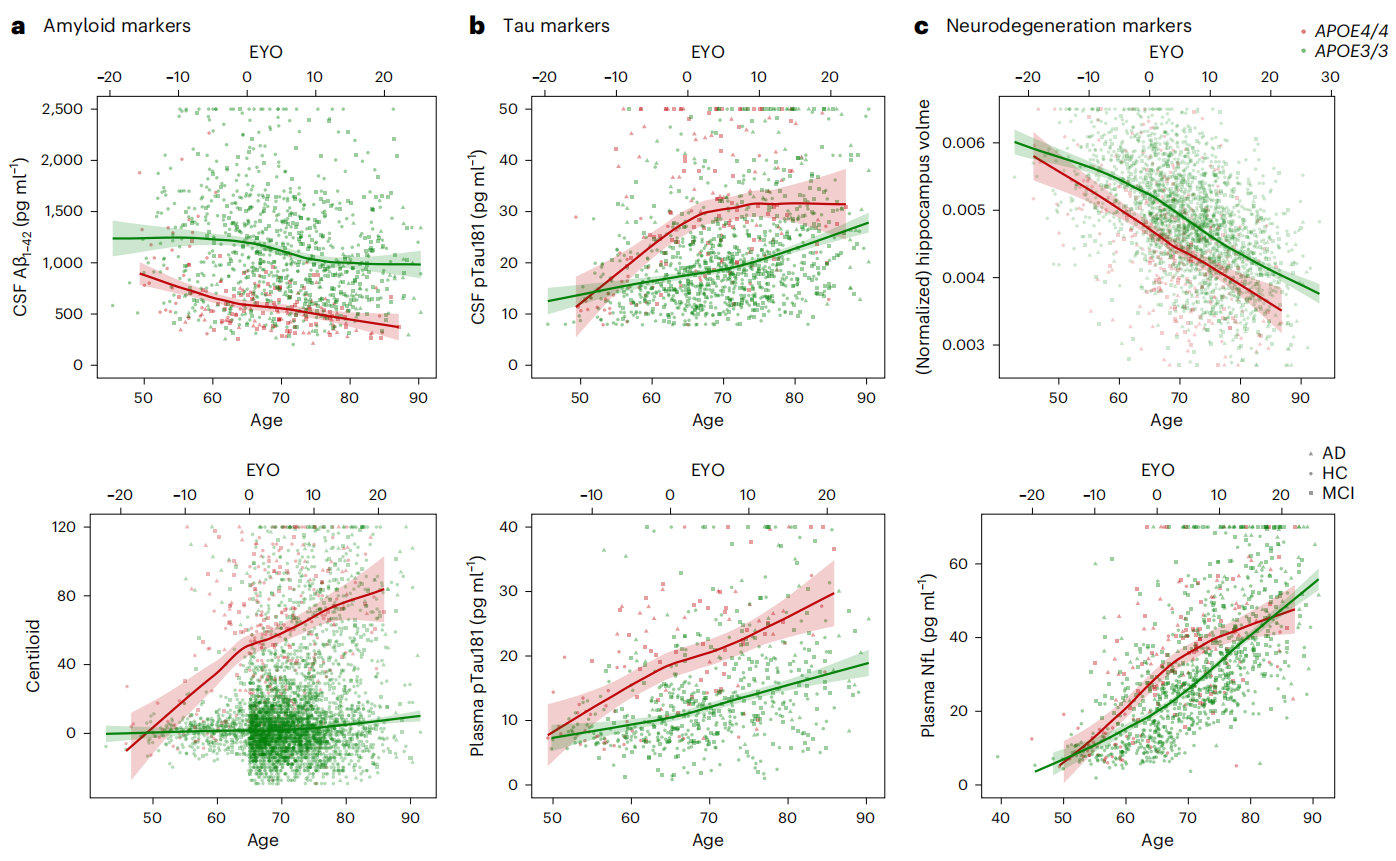
图3 APOE4 纯合者生物标志物随年龄的变化
此外值得一提的是,携带一条 APOE4 等位基因和一条 APOE3 等位基因的杂合者,其各种表型现象均处于 APOE3 纯合者与 APOE4 纯合者之间,这说明了 APOE4 具有剂量依赖性,携带越多 APOE4 等位基因,症状则会更严重。
总的来说,通过以上的数据结果,研究团队认为 APOE4 纯合完全符合了有基因定义的 AD 三大特征,认为我们不能再仅仅将 APOE4 视为 AD 的风险基因,而是应当进行观念改变,像将 APP、PSEN1 和 PSEN2 三基因突变携带者定义为罹患 ADAD 一样,将 APOE4 纯合视为 AD 的致病基因,定义出一类全新的 AD 类型。
同期,美国格莱斯顿神经疾病研究所的黄亚东教授等人在Nature Medicine期刊上发表了APOE4 homozygosity is a new genetic form of Alzheimer’s disease的评议文章[3],对本文的研究内容做出了高度评价(图4)。评论指出APOE4纯合者约占全球人口比例的 2%,因此 APOE4 纯合可能是世界范围内最流行的孟德尔遗传病之一,将 APOE4 纯合定义为致病基因不仅能够提高人们对 AD 的认识,也能促使 AD 的诊断、管理和护理策略发生关键变化。
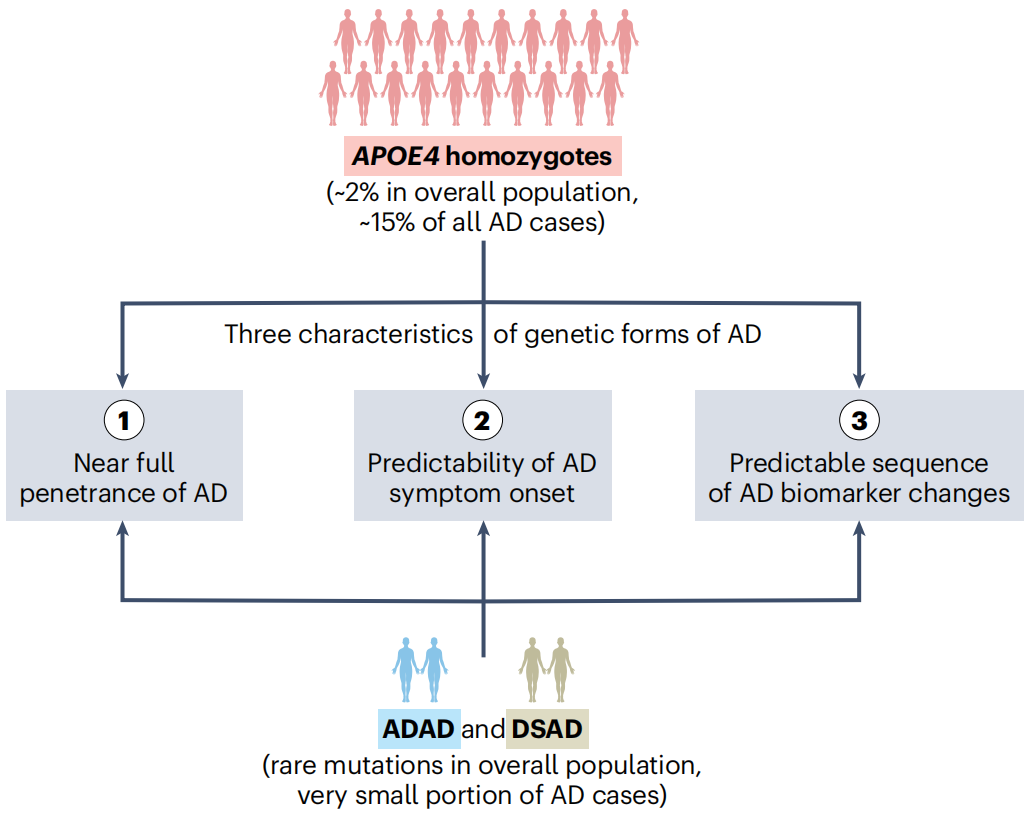
图4 APOE4 纯合符合由基因定义的 AD 三大特征
将 APOE4 纯合定义为 AD 的致病基因也能够促使研究者去了解 APOE4 纯合导致 AD 背后的具体机制,也为药物的开发开拓出新的道路方向,本篇研究更是为基于 CRISPR 的基因疗法奠定了坚实的理论基础。实际上,已有许多研究报道了 APOE4 缺陷对于 AD 病理特征具有缓解作用,如 Michael D. Greicius 研究团队[4]以人体数据证实了 APOE4 缺陷不但人正常,并且长寿,且不会导致高胆固醇血症,这说明 APOE4 缺陷对于人体而言是可耐受的。Anastasia Khvorova和Chantal M. Ferguson 领导的团队[5]则发现利用小干扰 RNA(siRNA)去沉默 APOE4 基因的表达,能显著改善 AD 小鼠模型的病理特征。对于背后的机制,近日美国斯坦福大学医学院 Tony Wyss-Coray 团队发表在Nature期刊上的APOE4/4 is linked to damaging lipid droplets in Alzheimer’s disease microglia研究发现 APOE4 会加剧小胶质细胞中脂滴的积累,从而引起神经元毒性导致细胞死亡[6]。
此外,将 APOE4 纯合定义为 AD 的致病基因对于临床试验设计也能产生重大影响。到目前为止,APOE4 纯合从未作为一个单独分组出现在临床试验设计中,而本篇研究的出现提醒了人们必须认识到 APOE4 是试验设计、患者招募和数据分析的关键参数,APOE4 纯合子和杂合子必须明确分离。这种方法可以提高治疗效果,并能更有效地针对基因定义的患者群体定制治疗干预措施。
参考文献:
[1] Fortea J, Pegueroles J, Alcolea D, et al. APOE4 homozygozity represents a distinct genetic form of Alzheimer's disease.Nat Med. Published online May 6, 2024. doi:10.1038/s41591-024-02931-w
[2] Bellenguez C, Küçükali F, Jansen IE, et al. New insights into the genetic etiology of Alzheimer's disease and related dementias.Nat Genet. 2022;54(4):412-436. doi:10.1038/s41588-022-01024-z
[3] Xu Q, Liang Z, Huang Y. APOE4 homozygosity is a new genetic form of Alzheimer's disease.Nat Med. Published online May 6, 2024. doi:10.1038/s41591-024-02923-w
[4] Chemparathy A, Le Guen Y, Chen S, et al. APOE loss-of-function variants: Compatible with longevity and associated with resistance to Alzheimer's disease pathology. Neuron. 2024. doi:10.1016/j.neuron.2024.01.008
[5] Ferguson CM, Hildebrand S, Godinho BMDC, et al. Silencing Apoe with divalent-siRNAs improves amyloid burden and activates immune response pathways in Alzheimer's disease. Alzheimers Dement. Published online February 20, 2024. doi:10.1002/alz.13703
[6] Haney MS, Pálovics R, Munson CN, et al. APOE4/4 is linked to damaging lipid droplets in Alzheimer's diseasemicroglia.Nature. 2024;628(8006):154-161. doi:10.1038/s41586-024-07185-7
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
