2 型糖尿病通常始于外周组织的胰岛素抵抗,并随着胰岛 β 细胞量减少或 β 细胞去分化而逐渐丧失胰岛功能。超过 30% 的 2 型糖尿病患者最终需要胰岛素治疗来控制血糖。胰岛移植可有效治疗胰岛素依赖型糖尿病。在肾移植患者中,胰岛移植后代谢改善情况与移植肾的功能及长期存活有关。此外,供体器官的严重短缺对胰岛移植的临床应用也造成阻碍。
近日,海军军医大学第二附属医院(上海长征医院)殷浩教授团队联合中国科学院分子细胞科学卓越创新中心程新教授团队在 Nature 旗下的 Cell Discovery 报道了**首例干细胞来源的“自体再生胰岛”移植治疗胰岛功能受损的 2 型糖尿病患者。
体外分化的“自体胰岛组织”
由人类多能干细胞(hPSC)产生的胰腺祖细胞或胰岛组织已被证明可以在糖尿病动物模型中存活、发挥作用和逆转高血糖。最近的一项临床试验表明,植入 1 型糖尿病患者皮下的 hPSC 来源的胰腺内胚层细胞,能够进一步成熟为具有餐时反应的 β 样细胞并分泌胰岛素,尽管其分泌水平还不足以替代外源性胰岛素。关于干细胞的研究结果提示非致瘤性的人内胚层干细胞(EnSCs)似乎更适合作为大规模生成胰岛细胞的前体。
研究人员实现了在体外培养分化自体 EnSCs 并产生自体胰岛组织(E-islets),完成了首例胰岛素分泌受损的 2 型糖尿病患者的肝内移植。
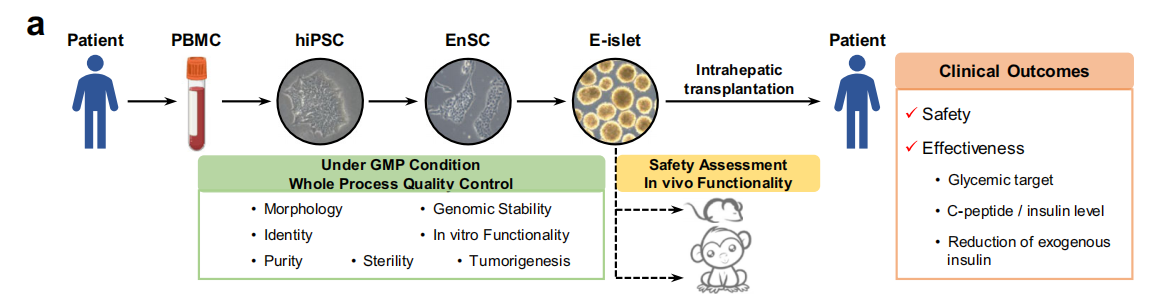
图:E-islets 的产生、质量控制以及移植的安全性/有效性评估所涉及的主要过程简要示意图。
病例介绍
该例患者为 59 岁男性,有 25 年 2 型糖尿病病史,2017 年 6 月出现终末期糖尿病肾病并接受肾移植。2019 年 11 月起出现血糖控制不佳,血糖水平波动在 3.66-14.60mmol/L 之间。由于担心低血糖发作以及血糖控制不佳对移植肾脏的长期生存产生不利影响,患者同意使用自体 E-islets 进行移植治疗。
患者接受了经皮肝门静脉介入输注移植,在基线、第 4、8、12、16、20、24、36 和 48 周以及之后的指定时间点检测内分泌功能和糖尿病特异性指标,并使用连续血糖监测系统(CGM)对血糖进行 24 小时实时测量。在随访期间,移植物耐受性良好,没有形成肿瘤或发生严重的移植物相关不良事件。
在 116 周内随访监测了三个主要临床结局,即血糖指标、外源性胰岛素的减少以及空腹和餐后的循环 C 肽/胰岛素水平。早在移植后第 2 周,就观察到患者血糖控制的明显变化。手术后血糖变异性降低,表现为**稳定的空腹血糖浓度和餐后血糖浓度的显著降低。值得注意的是,胰岛素需求逐渐减少,到第 11 周结束时完全停药。口服降糖药从第 44 周开始逐渐减少,并在第 48 周(阿卡波糖)和第 56 周(二甲双胍)停药。与术前水平相比,术后平均空腹 C 肽水平增加了 3 倍。
重要的是,在术后 116 周的整个随访期间未观察到低血糖或严重高血糖发作。
未来展望
总的来说,研究人员报道了首次使用自体 E-islets 治疗胰岛功能受损的 2 型糖尿病患者。从hPSCs 或 EnSCs 中提取胰岛组织为组织替代疗法提供了前所未有的新来源。而 EnSCs 在体内是非致瘤性,并具有内胚层特异性和在发育上更接近胰腺谱系的优势,可实现有效、大量的胰岛组织再生。
其次,研究选择了 2 型糖尿病而不是 1 型糖尿病患者,不仅排除了自身免疫性疾病对 E-islets 移植和功能评估的干扰,而且还扩大了胰岛移植的适应证范围。
这项研究的局限性在于不能完全排除残余的内源性胰岛在手术后获得功能改善的可能性。因此,未来需要增加样本量,并对胰岛 β 细胞完全丧失的 1 型糖尿病患者进行更多试验。
未来的研究还需要解决将干细胞来源的胰岛作为药物的药效学问题,将干细胞来源的胰岛移植应用于糖尿病的其他亚型,并产生无需免疫抑制的“通用胰岛组织”作为现成的产品来治疗糖尿病。
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
