根据国家卫生健康委员会发布的《卵巢癌诊疗指南(2022 版)》,我国卵巢癌年发病率居女性生殖系统肿瘤第 3 位,仅次于子宫颈癌和子宫体恶性肿瘤,病死率位于女性生殖道恶性肿瘤之首,其 5 年生存率与诊断时的病程阶段密切相关。根据美国国家癌症研究所发布的数据,在早期的局部感染阶段,卵巢癌 5 年生存率为 92.4% ,而转移阶段 5 年存活率则下降至 31.5%。
卵巢深处盆腔,卵巢病变处于早期时常无特异临床症状,因出现症状就诊时,70% 的患者已处于晚期。因此卵巢癌的早期诊断具有重大意义。
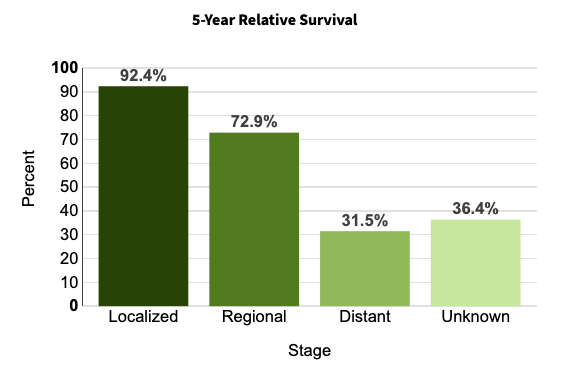
卵巢癌不同阶段的 5 年生存率
近日,中山大学肿瘤防治中心妇科刘继红教授团队,联合南方医科大学、华中科技大学同济医学院附属同济医院、浙江大学医学院附属妇产科医院,针对卵巢癌目前早期诊断困难、缺乏有效肿瘤标志物的困境,构建了卵巢癌诊断人工智能融合模型 MCF,输入常规实验室检验数据和年龄即可计算卵巢癌的患病风险。相关成果已发表于《柳叶刀·数字健康》(The Lancet Digital Health)。

研究亮点:
* 该研究收集了我国 3 家医院的数据,并使用基于多标准决策的分类融合 (MCF) 框架来开发模型
* 该模型识别卵巢癌的准确率优于 CA125 和 HE4 等传统生物标志物
* 该研究证明了低成本、易获得的常规实验室检测,具备成为有效卵巢癌诊断工具的潜力
汇集 3 家医院、1 万名患者、98 项相关检查及数据
研究人员收集了 2012 年 1 月 1 日至 2021 年 4 月 4 日期间,中山大学肿瘤防治中心、华中科技大学同济医学院附属同济医院、浙江大学医学院附属妇产科医院内,超过 1 万例患者(卵巢癌及子宫附件良性病变/正常体检女性患者)的 98 项实验室检查和临床特征数据。
其中,华中科技大学同济医学院参与者(共 3,007 人)的数据被选为训练集,并在该训练集上进行了五倍交叉验证。两个外部验证集分别来自浙江大学医学院妇女医院(共 5,641 人)和中山大学肿瘤中心(共 2,344 人)。
MCF:融合 20 个基础分类模型
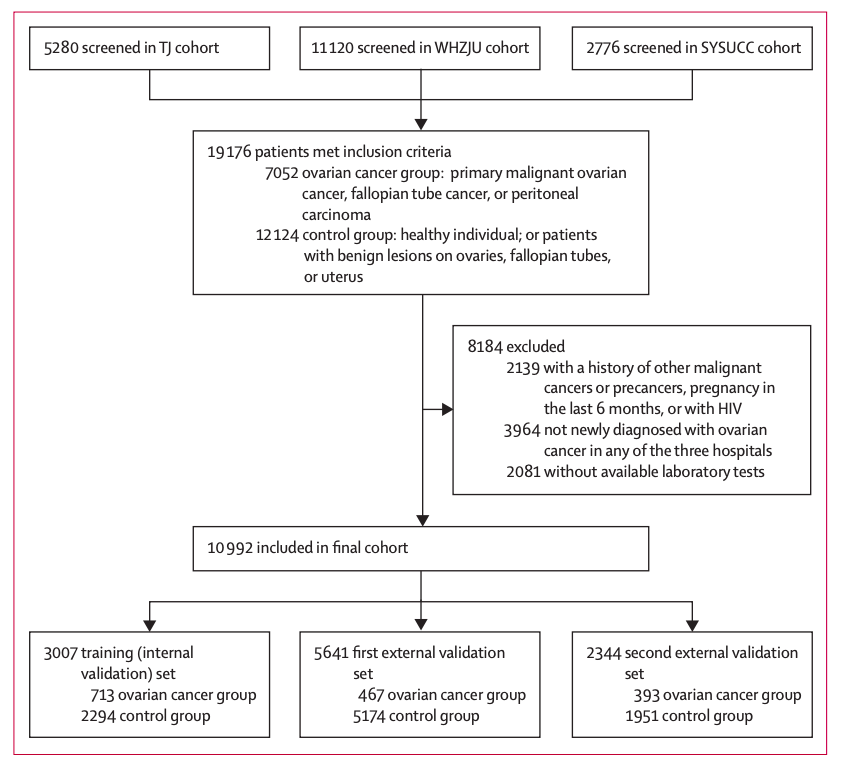
研究流程图
该研究招募了我国 3 个不同地区的大量参与者。3 个队列中卵巢癌诊断的中位年龄为 51-56 岁。然而,大规模数据也带来了一些问题。例如,多中心数据是异质的,不利于构建稳健的人工智能模型,并且存在一些缺陷,包括卵巢癌患者和对照参与者数量之间存在显著不平衡,单位不一致,以及大量的缺失值(内部验证集为 48.5%)。
为了解决这些数据问题,确保模型的稳健性,研究人员进行了大量的数据清洗工作,包括:
* 构建模型时,将 98 项实验室检测项目列为候选输入特征。对于单位不同的实验室检测项目,进行了单位统一处理。
* 缺失数据通过 MICE (multivariate imputation by chained equations) 算法进行估算。
* 为了减少机构间数据分布的差异,使用 Box-Cox 算法进行了数据调和,然后通过 min-max 标准化进行了数据规范化处理。
* 为了解决数据不平衡问题,采用了自适应综合采样方法,平衡比例为 0.5。
此外,MCF 框架是该研究团队在先前工作中提出的 H-MCF(基于 MCF 的分层预测方案)的一个变体,研究人员建立了 176 个基础分类模型,并结合了特征选择方法 (feature selection method) 与机器学习分类器 (machine-learning classifier),通过五倍交叉验证,从 176 个模型中选出前 20 个基础分类模型。其中 ,特征选择过程将识别最重要的 20 个特征,供分类器使用以生成一个基础分类模型。
随后,研究人员根据多准则决策理论 (multi-criterion decision-making) 估计每个模型的权重,最终融合其预测以达成一致性分类。
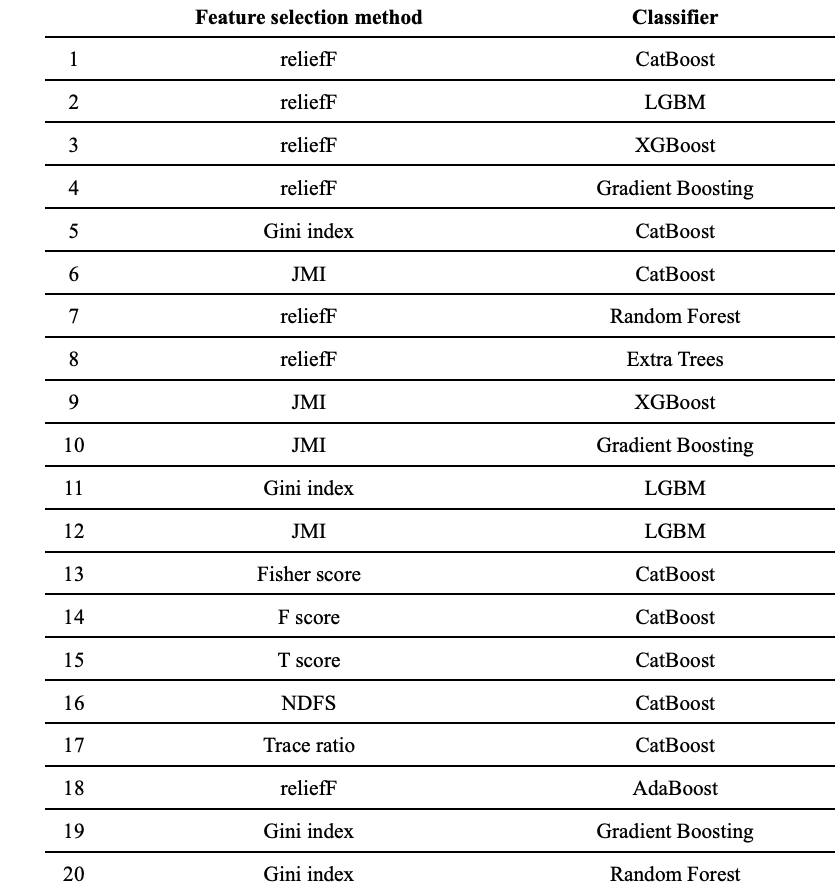
前 20 个基础分类模型
模型性能显著高于传统方法
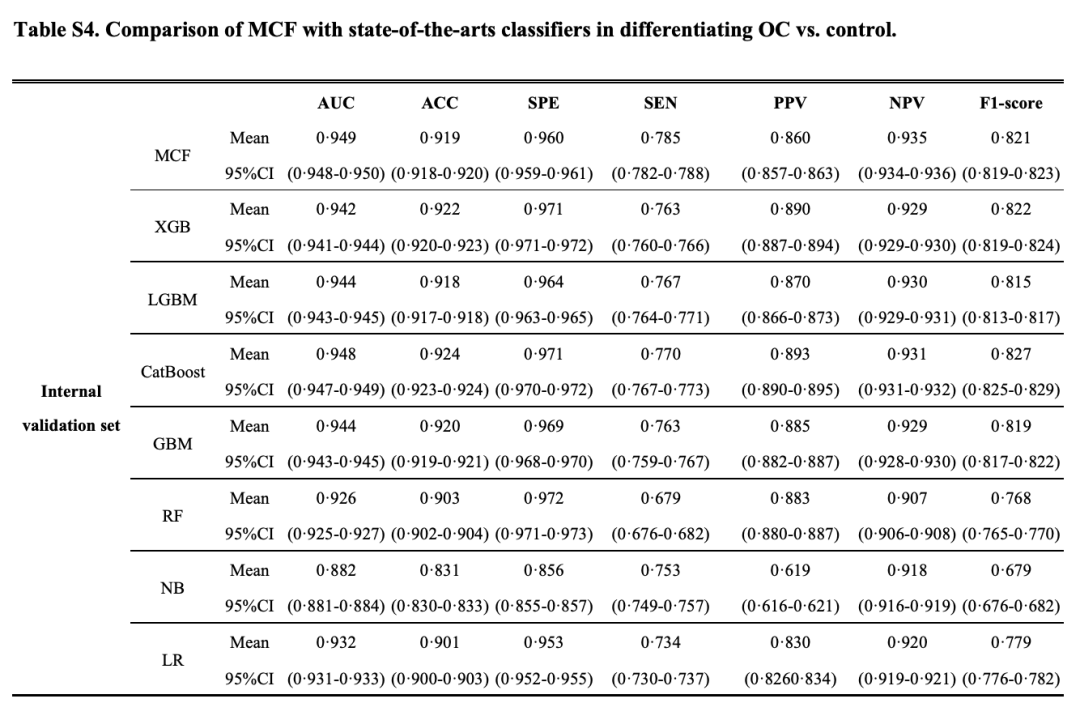
研究人员通过 AUC、准确性、特异性、敏感性、阳性预测值、阴性预测值和 F1 分数,来量化 MCF 模型预测准确性,结果如下图所示:
研究人员从前 20 个基础分类模型中选出的 52 个特征(51 项实验室检验指标和年龄),其中约 90% 的特征与卵巢癌的风险显著相关,并基于 SHAP(Shapley Additiveexplanation ,一种评估和解释模型预测的技术)构建了类似的一致性特征排名。单个特征的预测 AUC 范围为 0.477 (AFP) 至 0.886 (CA125),并且总体上与它们的排名一致。
其中,51 项实验室检验指标包含了常规血液检查、尿检、生化检查等,例如血小板 PLT、纤维蛋白原测定 FIB、评定炎症程度的指标 CRP、测定血清白蛋白水平的 ALB、红细胞沉降率 ESR、尿 ph 值等。下图 A 为检验指标的重要性排序。
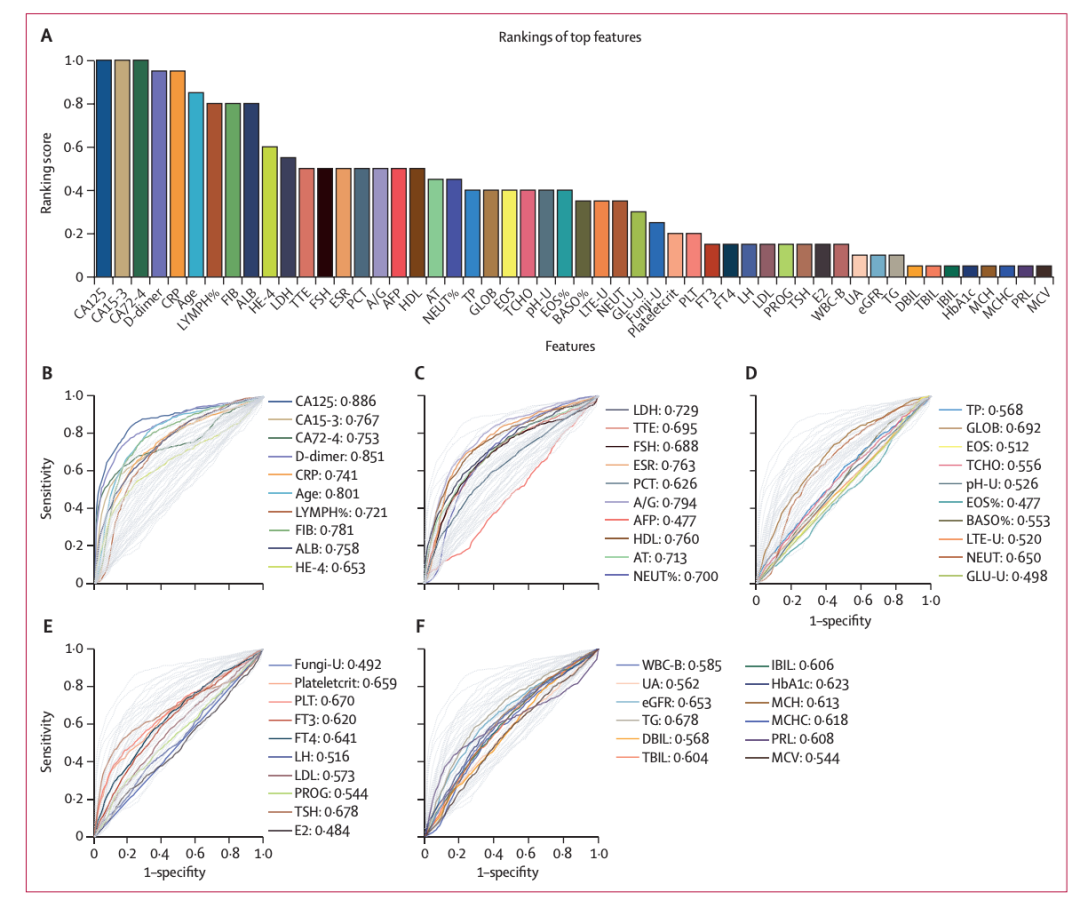
特征排名及相关分析
MCF 在内部验证集和两个独立的外部验证集上的 AUC 分别达 0.949 (95%CI 0.948-0.950)、0.882 (0.880-0.885) 和 0.884 (0.882-0.887)。
研究人员还将 MCF 与卵巢癌检测中的传统肿瘤标志物进行了比较。对于区分卵巢癌的所有 3 个验证集,MCF 的 AUC、敏感性和 F1 评分均高于传统肿瘤标志物,如下图所示:
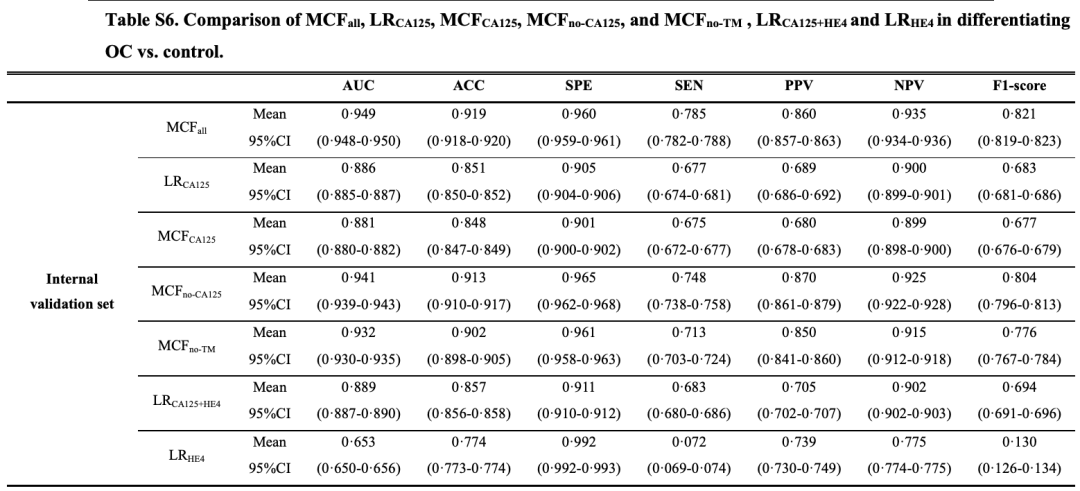
对于晚期卵巢癌与对照组的分类,MCF 在内部验证集中的 AUC 为 0.985;第一个外部验证集达到 0.972,第二个外部验证集达到 0.943。对于早期卵巢癌症与对照组的分类,MCF 在内部验证集中的 AUC 为 0.879,在第一和第二外部验证集中分别为 0.823 和 0.810。
研究结果显示,MCF 模型识别卵巢癌患者、特别是早期卵巢癌患者的 AUC 和灵敏度显著高于传统卵巢癌标志物 CA125、HE4 及两者联合,且在部分指标缺失的人群中依然可以对卵巢癌的风险进行较准确的预测,这表明 MCF 模型具有较好的稳定性,并对真实世界数据具有较好的兼容性。
此外,本研究还发现,除肿瘤标志物外,其他常规实验室检验,如 D-D二聚体、血小板计数等,也对卵巢癌诊断预测有较大贡献,提示这些检验指标相关病理生理过程可能在卵巢癌的发展过程中发挥了重要作用,其潜在机制值得进一步探讨。
AI 赋能基层医疗发展
根据「2022 年我国卫生健康事业发展统计公报」,尽管我国基层医疗卫生机构达到 979,768 个,占全国医疗卫生机构总数的 94.85%,但就诊疗量而言,基层医疗卫生机构诊疗量 42.7 亿人次,仅占全年总诊疗量的 50.7%。可以看出,我国基层医疗卫生机构数量占比较高,但诊疗量仍有较大上升空间。
此外据国家癌症中心的数据统计,在我国肿瘤医疗服务市场,公立三甲医院承担了超过 80% 的肿瘤治疗任务。这些三甲医院大多分布在省会城市,却要同时接待来自四面八方的患者,医生的压力可想而知。
但近些年人工智能的成熟应用给医疗行业带来了无限遐想,也为基层就诊提供了新思路。本研究构建的卵巢癌诊断模型 MCF 已开源,输入相应实验室检验数据和年龄即可计算患卵巢癌的风险值,无疑为该模型在基层医疗机构的普及提供了重要助力。
人工智能辅助诊断在基层卫生机构的配置至关重要,国务院此前印发的「关于进一步深化改革促进乡村医疗卫生体系健康发展的意见」中也提到,要加快推动人工智能辅助诊断在乡村医疗卫生机构的配置应用。
人工智能应用于基层卫生机构,不仅可以将医疗信息处理为结构化数据,解决「数据孤岛」和数据质量问题,为区域内的医疗信息互联共享打下基础;还能通过辅助问诊、辅助诊断、慢病管理等功能,提高基层诊疗水平,降低漏诊、误诊概率,让更多地方享受到高质量的诊断和治疗。
参考资料:
1.https://www.sysu.edu.cn/news/info/2331/1091611.htm
来源: HyperAI超神经


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 HyperAI超神经
HyperAI超神经 
