DME(糖尿病性黄斑水肿)是糖尿病的一种持续并发症,其特征是视网膜神经血管单位的退行性变。“糖尿病不可怕,可怕的是并发症”——糖尿病性黄斑水肿影响着4%的糖尿病患者,仍然是导致全球人口失明的主要原因之一 [1]。视网膜有精细的血管化,以维持升高的视网膜视觉所需求的能量,因此神经视网膜及其血管特别容易受到代谢紊乱的影响,如糖尿病视网膜病变(DR)。值得注意的是:在糖尿病视网膜病变的不同阶段,血-视网膜屏障(BRB)的破裂导致糖尿病性黄斑水肿,其中血浆外渗和循环蛋白进入视网膜内和视网膜下间隙会导致肿胀和随后的视力丧失。
现有疗法的分析及新疗法开发的必要性
糖尿病性黄斑水肿是糖尿病最常见的影响视力并发症,目前主要包括2类疗法:1:系统治疗:控制高血糖和高血压;2: 局部治疗:抗血管内皮细胞生长因子(VEGF)抗体,糖皮质激素(玻璃体内注射)和激光。现有疗法的仅对大约一半的糖尿病患者有效,且需要频繁注射于眼部,同时存在各种副作用[2] (图1)。目前迫切需要更有效的的新疗法。
图1:糖尿病性黄斑水肿现有疗法的对比分析
近日,来自加拿大蒙特利尔大学-罗斯蒙特医院研究中心、美国Unity Biotechnology的研究人员在Nature Medicine期刊上发表了题为Therapeutic targeting of cellular senescence in diabetic macular edema: preclinical and phase 1 trial results 的最新成果。文章提出了针对糖尿病性黄斑水肿的抑制细胞衰老机制并评估了一种抗衰老药物UBX1325。其数据显示UBX1325通过抑制抗凋亡的B细胞淋巴瘤-2(BCL-2)家族成员BCL-xL,特异性靶向衰老细胞——注射一针,疗效可至少持续半年——对抗VEGF疗法难治的糖尿病性黄斑水肿患者的视力和黄斑厚度具有有益和长效的改善作用。
抗衰老治疗(UBX1325)的理论依据
糖尿病对视网膜造成多种代谢应激,包括高血糖、循环和组织氨基酸和脂质浓度的改变,以及继发性神经炎症,导致视网膜神经血管单元的破坏[3]。这些应激导致内质网应激、自噬和诱导细胞死亡途径,如细胞凋亡、焦亡和铁死亡。虽然糖尿病视网膜病变是多因素起源的,但与糖尿病性黄斑水肿中血管功能障碍相一致的潜在统一的病理机制可能为细胞衰老。已经进入衰老状态的细胞仍然具有生存活性和代谢活性,产生广泛的炎症因子和分泌金属蛋白酶,这种状态被称为与衰老相关的分泌表型(SASP)并改变近端细胞环境和细胞外基质[4][5]。中枢神经系统内的衰老内皮细胞(ECs)失去了细胞连接的完整性和血-视网膜屏障的破裂。有证据表明,衰老细胞在糖尿病视网膜中;积累更具体地说,是在糖尿病视网膜中积累[6][7]。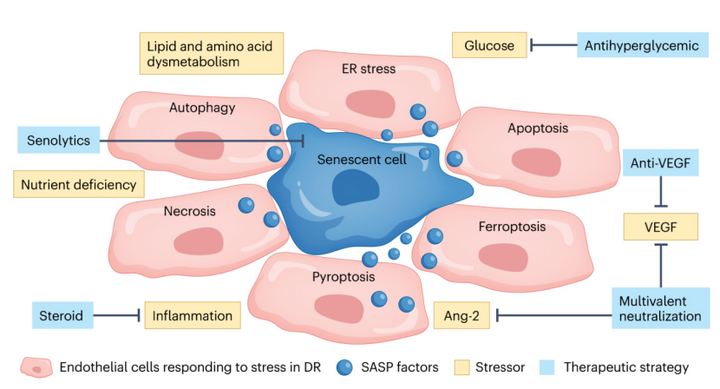
图2衰老治疗作为糖尿病黄斑水肿的一种新选择。在多种机制中,衰老细胞失去细胞间连接,同时增加细胞旁通量,进一步促进血管生长邻近细胞的通透性,由SASP介导。衰老疗法恢复了血-视网膜屏障,而其他疗法针对各种细胞应激源。DR:糖尿病视网膜病变;ER:内质网。
UBX1325测试成果
基于现有的机制理论,Crespo-Garcia等人首先通过分析人供体视网膜和玻璃体、胰岛素缺陷小鼠和人视网膜内皮细胞,建立了糖尿病性黄斑水肿病理生理学中衰老的生化、生理和病理证据。他们证实了先前关于糖尿病患者玻璃体中细胞因子水平升高的发现。
进一步探究中,作者为了识别在糖尿病患者中衰老的视网膜细胞群,对来自糖尿病小鼠的单细胞进行单细胞测序RNA-seq,数据显示最受干扰的细胞群是视锥光感受器、Müller胶质细胞和内皮细胞(图3)。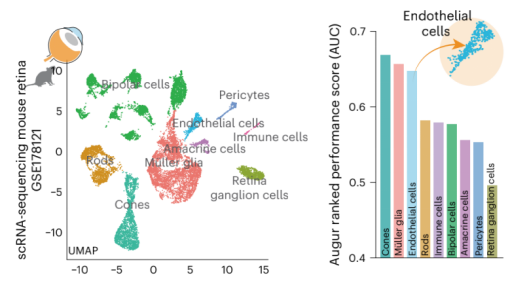
图3:单细胞测序识别糖尿病患者中衰老的视网膜细胞群
如上所述,糖尿病可诱导视网膜内皮细胞的衰老,且持续的高血糖将驱动内皮细胞的衰老;已有文献报道BCL-2家族蛋白对衰老细胞的存活至关重要,并且可以通过细胞凋亡来靶向清除衰老细胞[8]。为了确定靶向BCL-xL是否能改善糖尿病小鼠视网膜的屏障功能,作者在视网膜病变小鼠玻璃体内注射UBX1325(一种具有抗衰老特性的小分子BCL-xL抑制剂),数据显示可减少Caspase的活性;在糖尿病变小鼠玻璃体内注射UBX1325,数据显示降低视网膜血管的通透性(图4)。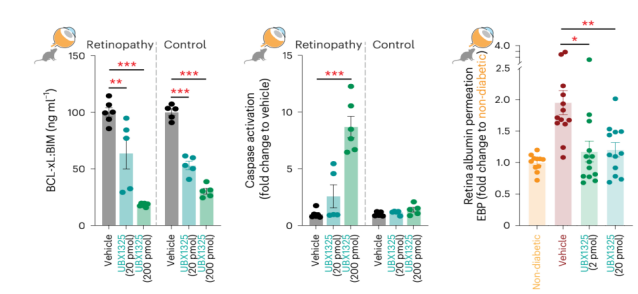
图4: UBX1325能改善糖尿病小鼠视网膜的屏障功能
最鼓舞人心的是:在一项临床1期研究中,入组抗-VEGF治疗糖尿病性黄斑水肿无效的8名患者,单次玻璃体内注射UBX1325后,视网膜功能得到改善;黄斑厚度也下降(图5)。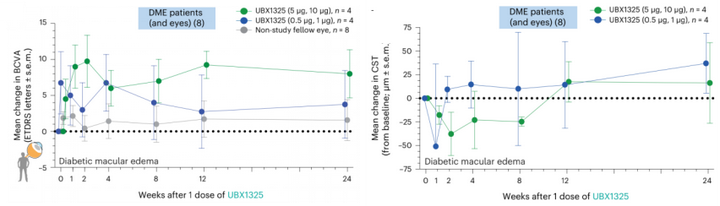
图5: UBX1325的临床1期数据
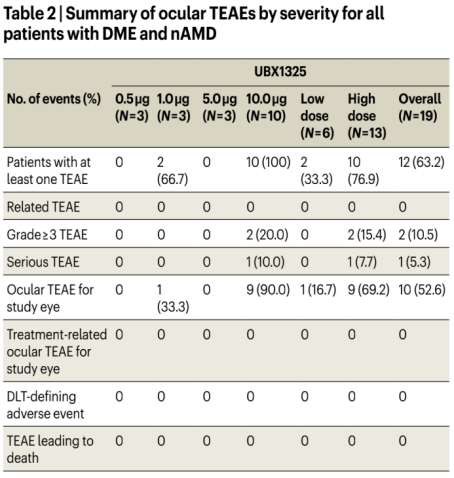
目前的一期临床数据未发现与UBX1325相关的严重眼部或全身性不良事件(Table1,2)。但有一点需特别注意:虽UBX1325没有安全性问题的报道,但这是一项短期研究,该药物的安全性值得进一步评估。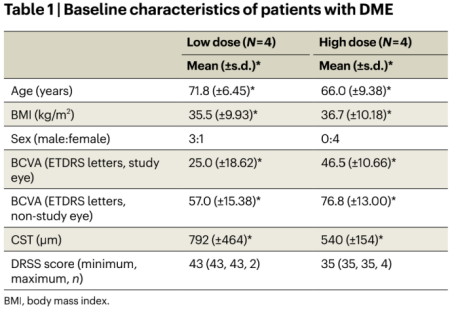
综上所述:作者最新发表的文章内,通过多种模型及技术对“清除衰老细胞以改善与衰老相关的疾病”的概念完成了进一步的探究,并提供了支持这一想法的临床证据:在糖尿病期间,衰老的内皮细胞在视网膜血管中积累,并导致视网膜微炎症的升高和血-视网膜屏障的破裂,最终导致视觉功能下降。玻璃体内只需注射一针小分子 BCL-xL抑制剂,即可至少半年内消除衰老的内皮细胞,从而减少局部炎症和血管的再生并改善屏障功能,最终视觉功能得到了改善(图6)。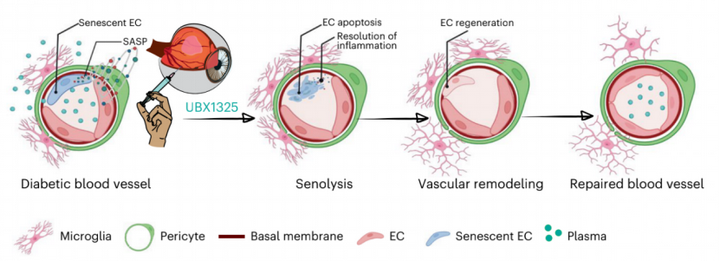
图6:糖尿病性黄斑水肿中衰老疾病假说的示意图
展望
UBX1325可能是第一个通过清除衰老细胞改善糖尿病性黄斑水肿的药物,但它不是最后一个。目前多种抗衰老药物已被证明可以调节线粒体功能障碍和病理磷酸化信号-这是糖尿病并发症治疗的潜在靶点[9]。线粒体靶点(和相关的衰老药物)对于糖尿病性黄斑水肿的血管和神经改变的治疗还有待评估。磷酸化信号SRC和磷酸肌醇3-激酶可诱导血管内皮细胞中血管通透性,也是抗衰老药物的靶点。还有一些药物,如二甲双胍,**它通过调节而不是去除衰老细胞,**抑制SASP的分泌,并可能减缓与年龄相关的变性。目前基于人工智能AI探究衰老相关靶点的概念验证和化合物方兴未艾,这也极可能有利于糖尿病视网膜疾病患者的治疗[10]。
在糖尿病视网膜病变中存在细胞应激和死亡的多种机制,因此针对此概念的治疗方式的开发将是非常潜力的方向。清除衰老细胞治疗是一种很有前景的新兴策略;干细胞移植再生是另一个。目前,Crespo-Garcia 等人的研究标志着治疗糖尿病性黄斑水肿的视网膜再生的新时代的开始。### 参考文献:
- Stitt, A. W. et al. The progress in understanding and treatment of diabetic retinopathy. Prog. Retin. Eye Res. 51, 156–186 (2016).
- Ciulla, T. A., Pollack, J. S. & Williams, D. F. Br. J. Ophthalmol. 105, 216–221 (2021).
- Duh, E. J., Sun, J. K. & Stitt, A. W. Diabetic retinopathy: current understanding, mechanisms, and treatment strategies. JCI Insight 2, e93751 (2017).
- Coppe, J. P. et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol. 6, 2853–2868 (2008).
- Coppé, J. -P., Desprez, P. -Y., Krtolica, A. & Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu. Rev. Pathol. 5, 99–118 (2010).
- Su, L. et al. Diabetic endothelial cells diferentiated from patient iPSCs show dysregulated glycine homeostasis and senescence associated phenotypes. Front. Cell Dev. Biol. 9, 667252 (2021).
- Oubaha, M. et al. Senescence-associated secretory phenotype contributes to pathological angiogenesis in retinopathy. Sci. Transl. Med. 8, 362ra144 (2016).
- Crespo-Garcia, S. et al. Pathological angiogenesis in retinopathy engages cellular senescence and is amenable to therapeutic elimination via BCL-xL inhibition. Cell Metab. 33, 818–832 (2021). 23. Palmer, A. K. et al
- Murakami, T., Gardner, T.W. Rejuvenation of diabetic macular edema with senolytic therapy. Nat Med 30, 346–347 (2024). https://doi.org/10.1038/s41591-024-02804-2.
- Wong, F., Omori, S., Donghia, N. M., Zheng, E. J. & Collins, J. J. Nat. Aging 3, 734–750 (2023).
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
