文章来源:“BTIT俱乐部”公众号

多囊卵巢综合征(PCOS)是育龄期妇女最常见的内分泌疾病,患病率在10%-13%之间。多囊卵巢综合征病因复杂,临床表现具有异质性,影响生殖、代谢、心血管和心理健康。来自新西兰奥塔哥大学的Rebecca E. Campbell在 Nature Reviews Endocrinology 发表了题为Beyond the ovary: rewiring our perspective on polycystic ovary syndrome 的文章,回顾了对多囊卵巢综合征发病机制的认识过程。
下丘脑-垂体-性腺轴(HPG)
多囊卵巢综合征是一种复杂的内分泌疾病,被定义为卵巢功能障碍,特征包括促性腺激素分泌紊乱、雄激素过量、慢性无排卵和多囊卵巢形态。20世纪90年代末的两项开创性研究挑战了卵巢在多囊卵巢综合征发病中的首要作用,发现大脑中的内在特征,特别是促性腺激素释放激素(GnRH)神经元网络,才是多囊卵巢综合征病理的核心。反馈调节是内分泌系统的基本特征,下丘脑-垂体-性腺轴(HPG)是指大脑中的促性腺激素释放激素神经元网络和性腺之间的相互反馈。从下丘脑、垂体和性腺释放的激素是这种反馈交流的关键部分。在下丘脑中脉冲释放的促性腺激素释放激素促进垂体促黄体生成素(LH)和促卵泡激素(FSH)的释放,这两种激素共同调节卵巢功能。卵巢分泌的性腺激素,反过来向下丘脑和垂体提供必要的反馈信号,调节促性腺激素释放激素和促黄体生成素的释放。
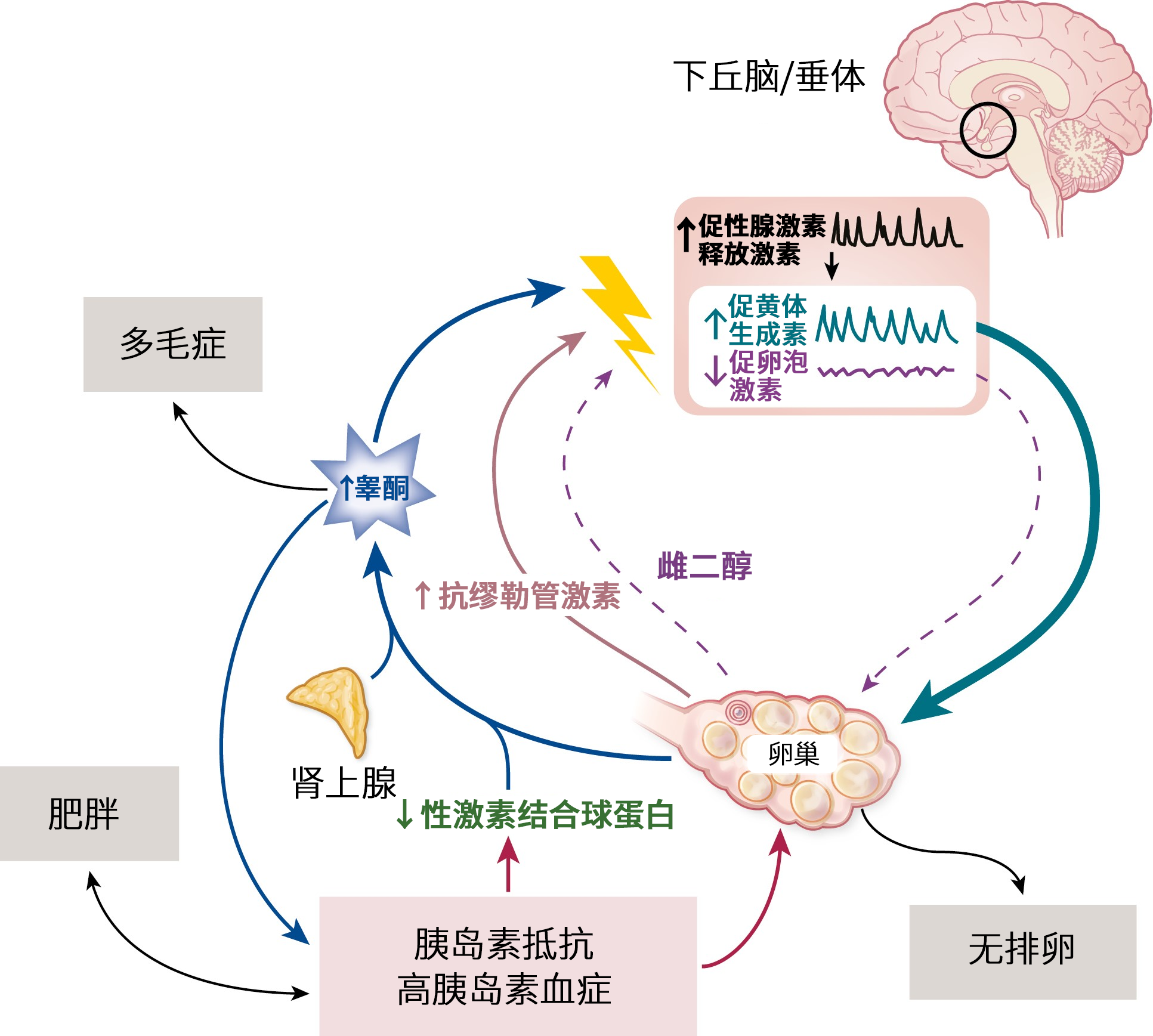
图:多囊卵巢综合征的病理生理学表现研究历程
在某些表型的多囊卵巢综合征中,下丘脑-垂体-性腺轴信号通路出现问题,促黄体生成素分泌持续升高,导致下游卵巢功能障碍,表现为无排卵、产生过量的雄激素。虽然促性腺激素释放激素和促黄体生成素水平的升高是卵巢性腺激素反馈减少的预期结果,但两个独立的研究小组认为可能是大脑而非卵巢导致了这种激素的反馈障碍。
Sarah L. Berga和John C. Marshall的研究小组都采用了连续采血的方法测定促黄体生成素、可反应促性腺激素释放激素分泌的动态变化,并认为多囊卵巢综合征患者促黄体生成素分泌亢进是下丘脑促性腺激素释放激素脉冲释放对性腺激素负反馈的敏感性受损所致。Daniels和Berga发现在服用含有雌二醇和孕酮的口服避孕药期间,月经周期正常女性的促黄体生成素显著降低,但无排卵且雄激素升高女性的促黄体生成素脉冲仍然升高。这些研究数据表明,与雄激素过量相关的促黄体生成素及促性腺激素释放激素升高是因促性腺激素释放激素对性腺激素负反馈具有抵抗性所致。
Pastor和他的同事通过另外一系列实验来支持这一理论。他们发现与没有多囊卵巢综合征的女性相比,有多囊卵巢综合征的女性在服用外源性雌二醇和孕酮时,促黄体生成素的抑制更慢、更弱,且需要更高剂量的孕酮。重要的是,有或没有多囊卵巢综合征的女性对外源性促性腺激素释放激素都有相似的促黄体生成素反应,说明了其垂体功能正常,功能障碍发生在中枢神经系统。这些研究强调了大脑网络调节促性腺激素释放激素释放在多囊卵巢综合征病因学中的作用。随后的研究表明,雄激素水平升高参与并促进了与多囊卵巢综合征相关的性腺激素负反馈受损及下丘脑-垂体-性腺轴过度激活。研究人员还利用转基因动物模型和越来越多的神经科学工具来确定该综合征的具体发病机制。
Sue Moenter的研究小组在具有类似多囊卵巢综合征特征的发育中雄激素化小鼠模型中,发现了促性腺激素释放激素神经元网络中的修饰性神经传递。在此之后,越来越多的研究确定了参与多囊卵巢综合征样发病的关键细胞类型和特定的神经元回路。在2023年发表的一篇论文中,Paolo Giacobini的研究小组发现仅促性腺激素释放激素神经元的短期过度激活就足以诱导持久的多囊卵巢综合征样特征,包括雄激素过量和异常高的促黄体生成素脉冲分泌。研究证据支持促性腺激素释放激素神经元网络在多囊卵巢综合征发病过程中的核心作用,并进一步证明了促性腺激素释放激素拮抗作用是一种潜在的靶向治疗方法。
未来方向
多囊卵巢综合征的病因很大程度上仍然未知,Berga和 Marshall研究小组的开创性研究帮助我们将注意力集中在卵巢之外和大脑的重要性上。多囊卵巢综合征对健康的影响从青春期持续到绝经后的整个生命周期。目前治疗方法主要是针对高雄激素血症、卵巢功能障碍的后果和/或相关代谢紊乱,缺乏特异性治疗。未来还需要进行更多研究,以发现关于多囊卵巢综合征神经内分泌功能障碍的发病机制和治疗手段。
参考文献:
[1] Teede HJ, Tay CT, Laven JJE, Dokras A, Moran LJ, Piltonen TT, Costello MF, Boivin J, Redman LM, Boyle JA, Norman RJ, Mousa A, Joham AE. Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2023 Sep 18;108(10):2447-2469. doi: 10.1210/clinem/dgad463. PMID: 37580314; PMCID: PMC10505534.
[2] Campbell RE. Beyond the ovary: rewiring our perspective on polycystic ovary syndrome. Nat Rev Endocrinol. 2024 Feb 20. doi: 10.1038/s41574-024-00963-3. Epub ahead of print. PMID: 38378986.
[3] Dapas M, Dunaif A. Deconstructing a Syndrome: Genomic Insights Into PCOS Causal Mechanisms and Classification. Endocr Rev. 2022 Nov 25;43(6):927-965. doi: 10.1210/endrev/bnac001. PMID: 35026001; PMCID: PMC9695127.
[4] Silva MSB, Decoster L, Delpouve G, Lhomme T, Ternier G, Prevot V, Giacobini P. Overactivation of GnRH neurons is sufficient to trigger polycystic ovary syndrome-like traits in female mice. EBioMedicine. 2023 Nov;97:104850. doi: 10.1016/j.ebiom.2023.104850. Epub 2023 Oct 27. PMID: 37898094; PMCID: PMC10630624.
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
