近日,美国哈佛大学(Harvard University)Richard Y. Liu课题组在经典的Suzuki-Miyaura反应中实现了形式上的乃春插入,即通过将Suzuki-Miyaura偶联和Buchwald-Hartwig偶联两个反应“强强联合”,直接实现了二芳基胺的合成。其中,大位阻膦配体的使用以及商业可得的胺化试剂的使用可以有效的兼容一系列不同取代的芳基(拟)卤化物和硼酸(酯)。此外,利用此策略还可以实现一系列其它亲电试剂与亲核试剂的偶联,并可兼容相应的四组分反应体系。文章链接DOI: 10.1126/science.adl5359。

(图片来源:Science)
过渡金属催化的交叉偶联反应合成有机化合物的重要工具。在化学家们所发展的一系列经典的偶联反应中,Suzuki–Miyaura偶联反应和Buchwald–Hartwig偶联反应是尤为重要、尤为强大的两类反应,其可以分别实现C–C键和C–N键的构建。最近,美国哈佛大学Richard Y. Liu课题组发展了将Suzuki-Miyaura偶联和Buchwald-Hartwig偶联相结合,在Suzuki-Miyaura反应中实现形式上的乃春插入,直接构建了二芳基胺(Fig. 1)。
首先,作者以4-甲氧基苯基三氟甲磺酸酯1a,4-三氟甲基苯硼酸3a和商业可得的胺化试剂DPPH(O-diphenylphosphinyl hydroxylamine)2a作为模板底物对反应条件进行探索。通过一系列条件筛选,作者发现当使用1a (1.0 equiv), 2a (1.5 equiv), 3a (2.0 equiv), t-BuBrettPhos Pd G3 (3 mol%), K3PO4 (4.0 equiv), 在2-MeTHF (0.2 M)中80 oC反应,可以以96%的产率得到二芳基胺产物4a (Fig. 1)。
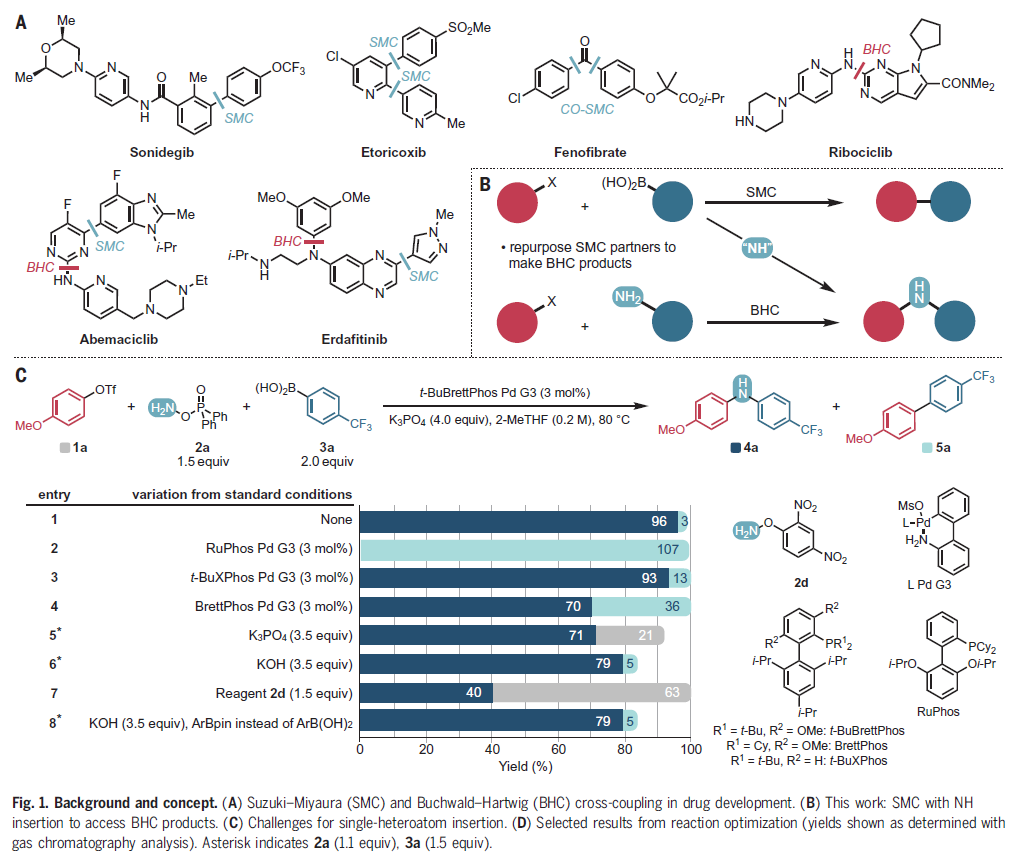
(图片来源:Science)
在得到了最优反应条件后,作者对此转化的底物范围进行了考察。实现结果表明,无论是不同取代的(杂)芳基三氟甲磺酸酯(Fig. 2)还是(杂)芳基溴化物和氯化物(Fig. 3)均可顺利实现此转化,以42-93%的产率得到相应的二芳基胺产物4a-4z, 4aa-4ai。其中,一系列不同的官能团如硝基、氰基、甲基、烷氧基、卤素、酰胺、酮羰基等均可兼容。值得注意的是,此转化可以实现简单天然产物L-tyrosine(4h, 68%, 91% ee)、estrone(4l, 44%)和flavone(4i, 56%)(4s, 45%)的衍生化,进一步证明此转化的实用性。

(图片来源:Science)

(图片来源:Science)
在对底物范围进行考察后,作者对所发展的偶联反应的应用性进行了探索(Fig. 4)。首先,此方法可以在偶联反应过程中通过DPPH试剂的引入可以方便的实现药物分子NH插入类似物的合成(Fig. 4A)。例如,用于治疗基底细胞癌的SMO抑制剂Sonidegib的合成主要通过1aj与3aj的Suzuki-Miyaura偶联反应。利用此策略,可以使用相同的试剂以33%的产率得到其类似物4aj。同样的,还可以以50%的产率得到用于治疗关节炎疼痛的Etoricoxib类似物4ak。随后,作者展示了几个含有芳酰氯的药物中间体和小分子药物的后期官能团化。利用此策略可以分别实现Loratidine和Fenofibrate的后期修饰,分别以58%和75%的产率得到相应的二芳基胺衍生物4al和4am(Fig. 4B)。接下来,作者使用[Fe(CO)5]作为羰基源,通过与1w, 3b和2a的四组分偶联反应以55%的产率实现了酰胺产物6ao的合成(Fig. 4C)。最后,作者还利用此策略还成功实现了胺化Tsuji–Trost烯丙基化反应,分别以54%和36%的产率得到相应的产物9ap(Fig. 4D)。

(图片来源:Science)
涉及芳基亲电试剂初始形成C-N键的反应途径可能包含芳基配体从Pd(II)向配位的和去质子化的2a发生1,2-迁移,从而产生酰胺络合物LPd(NHAr)OPOPh2(Fig. 5A)。这一过程类似于Knochel课题组提出的有机锌试剂与有机叠氮化物的亲电胺化过程。随后,得到的磷酸Pd(II)中间体经过与硼酸的转金属化和还原消除得到所需的产物。此外,作者在碱存在下通过Pd-1与2a之间的化学计量反应得到3%的苯胺6d和25%的二芳胺7d,这表明在反应条件下(拟)卤化物可能生成C-N键(Fig. 5B)。且在没有其它亲核试剂存在的情况下,6d可以与Pd-1反应形成7d。
此外,涉及芳基亲核试剂来初始形成C-N键的途径同样是有可能的(Fig. 5A)。硼酸通过与诸如2d的试剂进行亲电胺化已有报道,但此类转化通常仅限于富电子底物,并且许多适合该过程的试剂在此三组分偶联反应中并不奏效。在作者所发展的最优反应条件下,对于某些底物组合,钯可以独立的将芳基硼转化为苯胺。其中有一种可能,这种苯胺可以通过经典的Buchwald-Hartwig途径实现芳基化,从而形成三组分偶联产物。然而,利用硼酸酯形成的C-N键的总量(4r和6r的产率总和)随着催化剂负载的增加而增加,且4r与6r的相对比例也随之增加(Fig. 5c)。可能的机理如下:芳基钯(II),硼酸和DPPH形成络合物,其中金属的Lewis酸性增加了氮原子的亲电性,从而促进了芳基从硼上迁移。由于这一反应途径,在相同条件下,胺化Suzuki反应的产率可以超过预先形成苯胺的Buchwald-Hartwig胺化反应。

(图片来源:Science)
总结:Richard Y. Liu课题组通过将Suzuki-Miyaura偶联和Buchwald-Hartwig偶联相结合,在Suzuki-Miyaura反应中实现形式上的乃春插入,直接构建了二芳基胺。反应中大位阻膦配体的使用以及商业可得胺化试剂的使用可以有效兼容一系列不同取代的芳基(拟)卤化物和硼酸(酯)。值得注意的是,利用此策略还可以实现一系列其它亲电试剂与亲核试剂的偶联,并可兼容相应的四组分反应体系。
文献详情:
Polpum Onnuch, Kranthikumar Ramagonolla, Richard Y. Liu*. Aminative Suzuki–Miyaura coupling. Science, 2024, 383, 1019-1024. https://www.science.org/doi/10.1126/science.adl5359.
来源: 化学加


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 化学加
化学加 
