帕金森病(Parkinson’s disease,PD)是一种常见的神经系统变性疾病,其临床表现主要包括静止性震颤、运动迟缓、肌强直和姿势步态障碍,同时患者可伴有抑郁、便秘和睡眠障碍等非运动症状。帕金森多见于老年人,平均发病年龄为60岁左右,40岁以下起病的青年帕金森病较少见。我国65岁以上人群PD的患病率大约是1.7%。大部分帕金森病患者为散发病例,仅有不到10%的患者有家族史。帕金森病最主要的病理改变有两点:中脑黑质多巴胺(dopamine, DA)能神经元的变性死亡;由α-突触核蛋白(α-Synuclein,α-syn)聚集而成的路易体(Lewy body)的形成。后者也是临床上诊断帕金森病的金标准。α-突触核蛋白(α-Synuclein,α-syn)在生理状态下是一种可溶性的胞浆蛋白。病理性状态下聚集在一起的α-突触核蛋白会形成有毒的多聚体和不可溶性的淀粉样纤维丝,从而导致诸如帕金森和路易体痴呆(Lewy body dementia)等一些与老龄化相关的神经退行性疾病。可怕的是,病理状态下聚集在一起的α-突触核蛋白具有像朊病毒一样的特性,即会像病毒扩散感染细胞那样,α-突触核蛋白聚集体也会从已感染的细胞扩散到未感染的细胞中,从而引起这些细胞中新的α-突触核蛋白聚集导致细胞死亡。并且这种扩散不仅仅能够发生在中枢神经系统(大脑和脊髓),也能够从支配身体的外周神经系统,如肠道神经系统中沿着脑-肠轴神经传导,将病理状态下的α-突触核蛋白传播进大脑中。由于α-突触核蛋白属于自身抗原(self-antigen)的一种,免疫系统无法对α-突触核蛋白聚集体做出有效反应去清除它们。但这也提示了一种潜在的治疗手段,即诱导人体自身的免疫系统识别异常聚集的α-突触核蛋白并做出反应。得益于固态核磁共振波谱(solid-state NMR spectroscopy)和电子冷冻显微镜技术(electron cryo-microscopy,cryo-EM)的发展,人们已清楚解析了从病人大脑中分离出来的α-突触核蛋白结构,这为改造和利用α-突触核蛋白提供了研究基础。近日,德国杜塞尔多夫大学物理生物学研究所Gültekin Tamgüney教授团队在Brain 期刊上发表了题为Vaccination with structurally adapted fungal protein fibrils induces immunity to Parkinson's disease 的研究论文,利用分子嫁接技术将α-突触核蛋白的构象表位移植到可溶性真菌蛋白HETs的朊蛋白结构域HETs(218-289)上,从而构建出一种四价疫苗,在帕金森模型小鼠上,接种该四价疫苗后,能够诱导机体产生能够识别α-突触核蛋白聚集体的抗体,保护其免受帕金森病的困扰,改善运动性能并延长生存期。真菌蛋白HETs的碳末端残基218-289在溶液状态是不定形结构状态,能够自发地组装在一起形成纤维状结构。基于此,利用基因突变,作者团队将能够代表病理状态下人源α-突触核蛋白构象表位的氨基酸残基嫁接到了HETs的218-289上,构建了4种候选疫苗——α-SC3,α-SC6,α-SC8和α-SC9。通过实时震荡诱导转化(real-time quaking induced conversion,RT-QuIC)实验和细胞诱导实验,作者团队证实这4种疫苗本身不会诱导α-突触核蛋白聚集体产生。
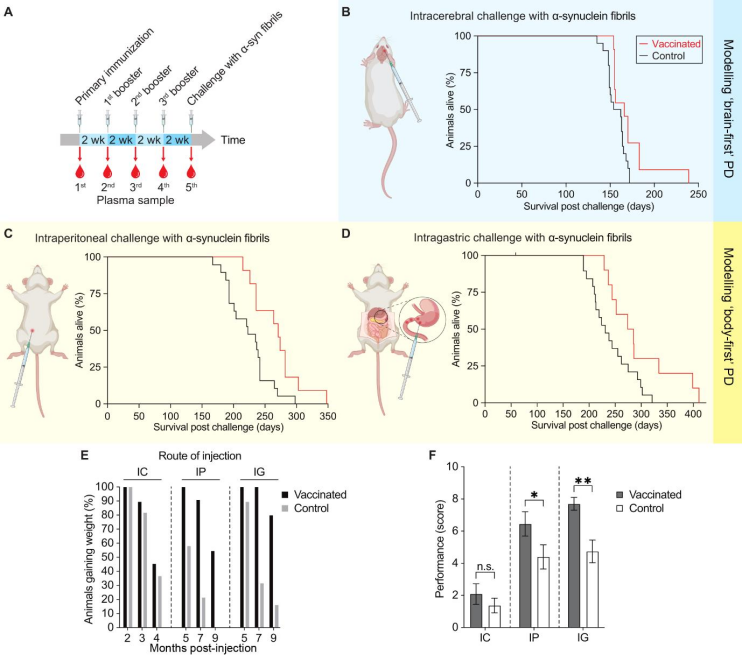
为了验证这些疫苗的效果,作者团队利用TgM83+/-小鼠作为研究工具,该小鼠模型会表达具有家族性A53T突变的人源α-突触核蛋白,但在缺乏诱导因素的情况下,不会自然发病。然而一旦注射了病人来源和人工合成的α-突触核蛋白聚集体后,该小鼠模型会很快表现出帕金森病理特征。作者团队每2周通过小鼠腹腔给一次四价疫苗,一共给4次疫苗,持续8周,最后再给小鼠注射α-突触核蛋白聚集体诱导帕金森病发作以评估疫苗效果。并且为了评估疫苗对机体自身抗体的诱导作用,在每次注射前后,作者团队都会收集小鼠血浆用以检测抗体含量(图1A)。为了分别模拟中枢起源(brain-first,α-突触核蛋白聚集体首先产生于大脑,并向外周扩散)和外周起源(body-first,α-突触核蛋白首先产生于外周,并向大脑扩散)的两种帕金森疾病亚型,作者团队分别将α-突触核蛋白直接注射到大脑中,或注射到腹腔/胃肠道中(图1 B—D)。作者团队发现在中枢起源的帕金森模型小鼠中,相较于未注射疫苗组,注射了四价疫苗后的帕金森模型小鼠生存期从154天延长到了166天,提高了约8%(n=20,小鼠数量为20只)。而在外周起源的帕金森模型小鼠中,注射了四价疫苗后的帕金森小鼠生存期分别从223天延长到了271天(提高了约22%,腹腔注射)和231天延长到了280天(提高了约21%,胃肠道注射)。作者团队也发现无论是哪种注射方式,注射了疫苗后的小鼠体重下降速度都变得更为缓慢,并且外周注射的小鼠体重下降速度比中枢注射的更为缓慢(图1 E)。利用转棒、握力和爬杆行为学实验,作者团队发现,对于中枢起源的帕金森病模型小鼠而言,注射了疫苗后的小鼠行为功能累积评分(2.09±2.12)高于未注射疫苗的小鼠(1.37±1.98)。对于外周起源的帕金森病模型小鼠而言,注射了疫苗后的小鼠行为功能累积评分(腹腔注射=6.45±2.50,胃肠道注射=7.70±1.25)显著高于未注射疫苗的小鼠(腹腔注射=4.40±3.35,胃肠道注射=4.74±3.11,图1 F)。此外作者团队也通过对小鼠血浆的分析,发现四价疫苗能够成功诱导机体产生识别α-突触核蛋白聚集体的抗体。图1 四价疫苗能够延长帕金森模型小鼠生存期并且改善其运动功能障碍综上,基于α-突触核蛋白结构被清楚解析和真菌蛋白HETs的特性,作者团队利用工程改造的四价疫苗能够诱导机体产生针对α-突触核蛋白聚集体的抗体,从而在小鼠模型上延缓帕金森病的发作时间,起到延长生存期和改善运动功能障碍的作用。值得注意的是,在本研究中,作者团队只选择了少量的构象表位位点来制作疫苗,而α-突触核蛋白上还存在着其它许多构象表位位点大有可为,也许能够改造出效果更好的疫苗。并且这种疫苗改造手段,不仅仅适用于α-突触核蛋白聚集体诱导的帕金森病,也非常适用于如Aβ/Tau聚集的阿兹海默症,或是Aβ前体聚集的II型糖尿病,或是其它由于蛋白错误折叠导致的疾病。相较于其他需要低温保存的药物,这种疫苗的还一个好处就是能够长时间储存在室温状态下,方便保存和运输。
[1] Pesch V, Flores-Fernandez JM, Reithofer S, Ma L, Özdüzenciler P, Busch Y, Sriraman A, Wang Y, Amidian S, Kroepel CVM, Müller L, Lien Y, Rudtke O, Frieg B, Schröder GF, Wille H, Tamgüney G. Vaccination with structurally adapted fungal protein fibrils induces immunity to Parkinson's disease. Brain. 2024 Mar 1:awae061. doi: 10.1093/brain/awae061. Epub ahead of print. PMID: 38428032.
投稿合作:chuhan.si@shulanfund.com
来源: BTIT俱乐部




 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
