发现历程
18世纪,在德国柏林有一名叫海因里希·狄斯巴赫(Heinrich Diesbach)的涂料工人,他的本职工作是用明矾提取胭脂虫中的胭脂虫红,加入硫酸亚铁并用固定碱处理使其沉淀。一天他的碱不够用了,便向炼金术士约翰·康拉德·迪佩尔(Johann Conrad Dippel)借了一些。与往常一样,在加入矾土后得到了白色的物质,但当他尝试蒸发浓缩的时候,他意外地发现沉淀物逐渐变成了深蓝色。他把这个现象告诉了迪佩尔,最后发现是迪佩尔之前反复用这种碱蒸馏一种“动物油”所导致的。在这个过程中,牛血通过焙烧进入碱液(草木灰)中,得到黄色晶体。当狄斯巴赫将这种黄色晶体放进氯化铁的溶液中,便产生了一种颜色很鲜艳的蓝色沉淀。狄斯巴赫经过进一步的试验,这种蓝色沉淀竟然是一种性能优良的颜料。这种蓝颜料很快被大量制备并投入使用,根据其发源地被命名为“普鲁士蓝”或“柏林蓝”5。
德国的前身普鲁士军队的制服颜色就是使用该种颜色,以至1871年德意志第二帝国成立后相当长一段时间仍然沿用普鲁士蓝军服,直至第一次世界大战前夕方更换成土灰色。
20年以后,一些化学家才了解普鲁士蓝是什么物质,也掌握了它的生产方法。原来,草木灰中含有碳酸钾,牛血中含有碳和氮两种元素,这两种物质发生反应,便可得到亚铁氰化钾,它便是狄斯巴赫得到的黄色晶体,由于它是从牛血中制得的,又是黄色晶体,因此更多的人称它为黄血盐。它与氯化铁反应后,得到亚铁氰化铁,也就是普鲁士蓝。
物理性质
普鲁士蓝具有立方结构,在常温常压下稳定,不溶于水,溶于酸、碱。色光有青光和红光两种,色泽鲜艳,着色力强,遮盖力略差。粉质较坚硬,不易研磨。能耐晒、耐酸,但遇浓硫酸煮沸则分解;耐碱性弱,即使是稀碱也能使其分解,不能与碱性颜料共用。失火时可用水、砂土扑救。
制备方法
用黄血盐钾与硫酸亚铁在微酸性溶液中反应生成亚铁氰化亚铁的复盐,再加硫酸氯酸钾氧化生成亚铁氰化铁与亚铁氰化钾的复盐:![]() 。如用黄血盐钠来制造铁蓝,则生成的复盐要用铵来代替其中的钠,即生成亚铁氰化铁与亚铁氰化铵复盐,因此铁蓝按原料不同分为钾铁蓝和铵铁蓝两种。将以上复盐再经过滤、漂洗、干燥、粉碎,制得深蓝色铁蓝颜料 。
。如用黄血盐钠来制造铁蓝,则生成的复盐要用铵来代替其中的钠,即生成亚铁氰化铁与亚铁氰化铵复盐,因此铁蓝按原料不同分为钾铁蓝和铵铁蓝两种。将以上复盐再经过滤、漂洗、干燥、粉碎,制得深蓝色铁蓝颜料 。
主要应用
普鲁士蓝颜色庄重,再加之廉价,并具有优良的着色能力,成为艺术家们最常用的颜料。毕加索在其创作的“蓝色时期”曾大量使用普鲁士蓝颜料作画。建筑学界中,蓝图的蓝指的就是普鲁士蓝,将画好的图纸盖在浸泡过柠檬酸铁铵溶液的纸张上,再经由阳光曝晒,使之未被线条遮盖的部分形成Fe2+,最后浸入铁氰化钾溶液中,在图纸空白处便出现了普鲁士蓝。

除了用作性能优良的蓝色染料,普鲁士蓝还有许多其它用途,尤其是普鲁士蓝纳米颗粒在医学、材料学等领域更是前景广阔。下面仅简要介绍其两种重要用途:
①治疗铊中毒6和排除放射性铯7
普鲁士蓝中的铁与氰基结合得足够紧密,剧毒的氰根离子几乎不可能游离出来,因此普鲁士蓝本身是无毒的。可溶性普鲁士蓝有一半的晶胞空隙中填充了钾离子,在剧毒的铊离子(Tl+)浓度较高时,会将普鲁士蓝中多余的钾离子置换出来(而不是填充剩余空隙),从而降低铊离子浓度,达到解毒的目的。
1994年11月24日起,清华大学学生朱令出现中毒症状,经诊断疑似两次摄取致死剂量的铊。经服用普鲁士蓝后,体内的铊被逐渐排出,但由于确诊时间过长,错过了宝贵的治疗时间,医生们虽然尽全力挽回了朱令的生命,但她却成了“植物人”。案件至今仍未破解。
与排除体内铊的作用机制相似,普鲁士蓝也能对与铊离子半径相近的铯离子(Cs+)有吸附作用。因此,普鲁士蓝也被用来修复被铯的放射性同位素铯-137污染的环境,和促进排除辐射病患者体内的放射性铯。
②用作普鲁士蓝基修饰电极传感器
在氧化酶的作用下,许多生物小分子能被氧气氧化为水和二氧化碳等物质,但其中不免有少量过氧化氢的产生。过氧化氢浓度与酶底物浓度成正比,因此通过检测过氧化氢浓度即可反映出氧化反应进行的程度。传统方法中电极所需电势较高,许多易氧化的物质参与反应会干扰测量结果。阿贝尔卡德·布瓦耶(Abelkad Boyer)等人利用普鲁士蓝修饰碳糊电极,在测定过氧化氢浓度方面表现出了更好的线性关系,可以实现浓度范围在1到100 ppm H2O2的测定8。
鉴于普鲁士蓝电催化剂相比于铂能更好地催化过氧化氢的还原反应,采用普鲁士蓝基修饰电极的第一代电流型葡萄糖生物传感器得以研制9。
利用普鲁士蓝优良的磁、电和光学性质,也可以制造出许多种其它的生物传感器,它们有寿命长、pH稳定性高等诸多优点。
贮存方法
普鲁士蓝应贮存在通风、干燥的库房中,贮存时要避免与氧化物、酸、氨、光接触 。
普鲁士蓝与滕氏蓝
普鲁士蓝由德国人狄斯巴赫所发现,而滕氏蓝(Turnbull's blue,简称TB),则是一种来自东方的颜料。普鲁士蓝和滕氏蓝都可作为蓝色颜料使用。由于普鲁士蓝的蓝色更深、原料更易得等原因而更受亲睐。

普鲁士蓝可由Fe3+与黄血盐反应制得,而滕氏蓝由Fe2+与赤血盐反应制得。如果按照复分解反应来看,那么应该是:
4Fe3++3[FeII(CN)6]4-→FeIII4[FeII(CN)6]3↓(普鲁士蓝)
3Fe2++2[FeIII(CN)6]3-→FeII3[FeIII(CN)6]2↓(滕氏蓝)
对比铁与氰基的比例,可以发现不溶性普鲁士蓝(insoluble Prussian blue)和滕氏蓝的化学式并不相同。但前人对它们做了许多研究,如单晶X射线衍射(single crystal X-ray diffraction)、中子衍射(neutron diffraction)、氧化电势(oxidization potential)的测量、顺磁磁化率(paramagnetic susceptibility)的测定、声子吸收光谱(phonon absorption spectrum)和穆斯堡尔谱(Mössbauer spectrum)等方法,表明它们具有相同的结构,均为FeIII4[FeII(CN)6]3·xH2O(x=14~16)11。
曾经认为普鲁士蓝的颜色是通过两种价态铁之间的共振实现的,但梅尔文·B·罗宾(Melvin B. Robin)通过量子力学的计算否定了这种观点。实际上,低自旋的Fe(II)与高自旋的Fe(III)之间电荷转移吸收可见光,形成蓝色。而通过对穆斯堡尔谱的解析,上式中的FeII3[FeIII(CN)6]2(铁氰化亚铁)被认为是滕氏蓝的前体物质或普鲁士蓝的电子激发态,而非滕氏蓝。
有人对比了两者的穆斯堡尔谱,认为普鲁士蓝和滕氏蓝是两种不同的物质12。虽然普鲁士蓝和滕氏蓝有相同的晶体结构和外接离子位置,但是它们的电子结构不同。对于普鲁士蓝为什么比滕氏蓝颜色更深,给出了两种合理的解释:一是在氰配合物中,中心离子FeIII比FeII的分裂能更大,发生d-d跃迁时吸收光的波长更短,颜色更浅,因此由含[FeIII(CN)6]3-的赤血盐制得的滕氏蓝比由含[FeII(CN)6]4-的黄血盐制得的普鲁士蓝颜色更浅。二是经过计算机拟合,滕氏蓝存在Fe2+与邻近[FeIII(CN)6] 3-之间的电子跃迁而普鲁士蓝中不存在,这也表明滕氏蓝电子跃迁所需能量大,颜色浅13。
除了不溶性普鲁士蓝和滕氏蓝,还有一种以胶体的形式存在的可溶性普鲁士蓝(soluble Prussian blue, KFeIII[FeII(CN)6])或称亚铁氰化铁钾(potassium ferric ferrocyanide)或六氰合铁(II)酸铁(III)钾(potassium ferric hexacyanoferrate) ,将黄血盐与铁盐混合即可得到。如若Fe3+过量,则得到不溶性普鲁士蓝。
电致变色
普鲁士蓝是常用的电致变色材料,具有多种变色特性。将普鲁士蓝涂在电极上,可通过电极电位来控制配合物中铁离子的价态,从而引起颜色的变化。15
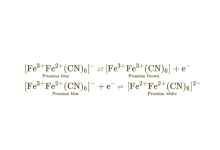
来源: 百度百科
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 百度百科
百度百科 
