伴随着全球人口老龄化的汹涌浪潮,骨质疏松症和肌肉萎缩(肌少症)这对“难兄难弟”已悄然成为老年人健康路上的两大“拦路虎”。
在我国,65岁以上人群中,骨质疏松症的阴影笼罩着32.0%的长者,而女性更是高达51.6%。骨骼肌和骨骼的衰老导致肌肉质量和功能下降以及骨密度降低,这两种情况共同被称为肌骨症(Sarcopenia-Osteoporosis Syndrome, SOS)。不仅共同削弱了骨骼和肌肉的力量,还大大增加了跌倒和骨折的风险,严重威胁着老年患者的独立生活能力。肌骨症对老年人的生活影响巨大,但目前的治疗手段仍然有限。
现有的治疗主要集中在缓解症状和预防骨折上,如使用钙和维生素D补充剂来提高骨密度,以及使用物理疗法来增强肌肉力量。然而,这些方法往往只能减缓病情的进展,而不能从根本上逆转肌肉和骨骼的衰老过程。面对这一挑战,中国工程院院士、中国人民解放军总医院骨科医学部主任唐佩福院士领衔的研究团队为我们提供了新的视角。团队的一项重要研究成果 Deciphering Immune Landscape Remodeling Unravels the Underlying Mechanism for Synchronized Muscle and Bone Aging 发表在《Advanced Science》期刊上,揭示了肌肉和骨骼衰老过程中的免疫景观重塑,这可能为开发新的治疗策略提供了潜在的靶点。*通过深入理解衰老过程中细胞层面的变化,科学家们有望开发出能够直接针对这些变化的治疗方法,从而更有效地预防和治疗肌骨症,改善老年人的生活质量。
唐佩福院士领衔的研究团队首先回顾了关于肌肉和骨骼衰老的现有知识。他们指出,目前对肌肉和骨骼同步衰老的分子机制了解尚不充分。Cruz-Jentoft和Sayer(2019)强调了肌骨症对老年人日常生活的严重影响,包括增加跌倒和骨折的风险。Kirk等人(2020)讨论了肌肉衰老的分子机制,而Compston等人(2019)则关注了骨质疏松症的流行病学和治疗策略。Karsenty和Olson(2016)提出了骨骼和肌肉之间的内分泌耦合关系,这可能在肌肉和骨骼的同步衰老中发挥作用。以上研究为理解肌肉和骨骼衰老提供了基础,但尚未完全揭示衰老过程中细胞层面的变化。研究团队通过单细胞RNA测序(scRNA-seq)技术,探索肌肉和骨骼在衰老过程中的细胞多样性和转录动态,以期揭示同步衰老的潜在机制。团队收集了不同年龄段人的肌肉和骨骼样本,分析了细胞类型和转录变化。他们识别了多种细胞类型,包括内皮细胞、成纤维细胞、淋巴细胞、间充质干细胞、平滑肌细胞、卫星细胞、髓样细胞和淋巴细胞。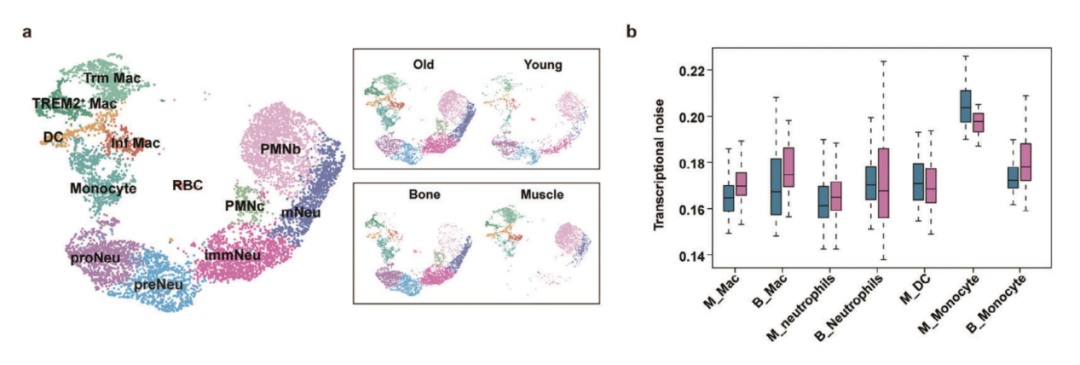
UMAP图展示了不同类型免疫细胞的分布和年龄相关的变化
特别值得注意的是,研究揭示了衰老过程中髓样细胞的变化,尤其是TREM2+巨噬细胞(Macrophages)在衰老肌肉和骨骼中的显著增多,这可能与肌肉萎缩和骨质流失有关,这表明这些细胞在肌肉和骨骼衰老过程中可能起着关键作用。这一发现揭示了衰老过程中肌肉和骨骼中的关键细胞类型和信号通路。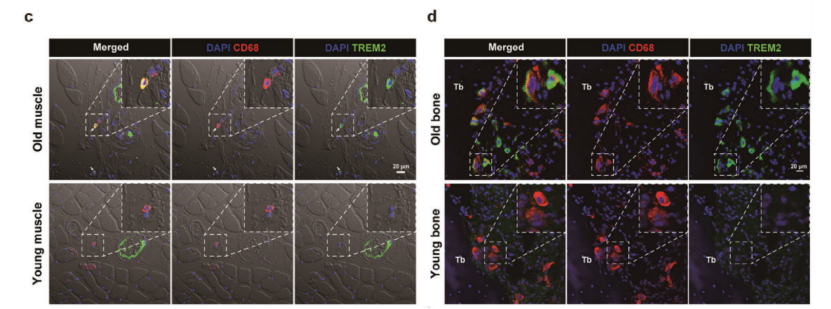
免疫荧光染色图
通过免疫荧光染色,研究者可以观察到这些细胞在组织中的定位和数量,以及它们是否随着年龄增长而发生变化
研究发现,与肌肉营养不良和骨质流失有关的基因,如分泌型磷蛋白1(SPP1),在TREM2+ Macs中高度表达。这表明SPP1可能是一个关键的分子,它在肌肉和骨骼衰老过程中起着核心作用,这为理解肌肉和骨骼同步衰老的机制提供了重要线索。研究观察到,在衰老的CD4+ T细胞中,存在一种向促炎表型的转变,这种转变由核因子kappa B亚基1(NFKB1)激活。在肌肉中,CD4+ T细胞经历了类似Th1细胞的分化,而在骨骼中,观察到了向Th17细胞的偏斜。这表明免疫系统在衰老过程中可能发生特定的变化,这些变化可能与肌肉和骨骼的衰老表型有关。
研究强调了退化的心肌细胞产生的含有BAG6的外切体(exosomes)在肌肉和骨骼衰老同步化中的作用。这些外切体通过其受体NCR3与骨骼中的Th17细胞进行通信,上调了Th17细胞中CD6的表达。随后,Th17细胞通过CD6-ALCAM信号与TREM2+ Macs相互作用,最终刺激TREM2+ Macs中SPP1的转录。这一发现揭示了肌肉和骨骼之间可能存在的远程细胞间通信机制,这种机制可能在衰老过程中调节肌肉和骨骼的同步衰老。退化的肌肉通过外泌体传递BAG6,这些外泌体通过血管运输并与骨骼中的Th17细胞相互作用,TREM2+ Macs促进破骨细胞的分化和骨吸收
参考资料:
[1] Compston JE, McClung MR, Leslie WD. Osteoporosis. Lancet. 2019;393(10167):364-374. doi:10.1016/S0140-6736(18)31703-0. PMID: 30640958.
[2] Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet. 2019;393(10183):2636-2650. doi: 10.1016/S0140-6736(18)32366-0. PMID: 30863398.
[3] Karsenty G, Olson EN. Endocrine regulation of bone development and homeostasis. Cold Spring Harb Perspect Biol. 2016;8(6):a017219. doi: 10.1101/cshperspect.a017219. PMID: 27223286.
[4] Kirk B, Zanker J, Duque G. Molecular mechanisms of muscle aging. J Cachexia Sarcopenia Muscle. 2020;11(1):609-620. doi: 10.1002/jcsm.12479. PMID: 31980573.
[5] Yin P, Chen M, Rao M, Lin Y, Zhang M, Xu R, Hu X, Chen R, Chai W, Huang X, Yu H, Yao Y, Zhao Y, Li Y, Zhang L, Tang P. Deciphering Immune Landscape Remodeling Unravels the Underlying Mechanism for Synchronized Muscle and Bone Aging. Adv Sci (Weinh). 2024 Feb;11(5):e2304084. doi: 10.1002/advs.202304084. Epub 2023 Dec 13. PMID: 38088531; PMCID: PMC10837389.
撰文:小鱼
审核:淑霞
排版:楚涵
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
