星形胶质细胞是神经系统中的重要组成部分,它们在对神经网络的维持和保护中发挥着至关重要的作用,并且具有复杂多样的功能。星形胶质细胞是否参与电信号传导是一个由来已久的问题,以往的体外实验给出了互相矛盾的结果。而近期在Nature发表的一项研究首次证实星形胶质细胞中存在一个特定的亚群,能够通过胞吐作用释放谷氨酸,从而参与神经系统的电信号传导。
撰文 | 维罗妮卡(清华大学医学院)
神经系统主要由两类细胞组成:神经元(neuron)和神经胶质细胞(neuroglia或glial cell,简称胶质细胞)。长期以来,人们普遍认为神经系统的功能活动主要由神经元承担,而神经胶质细胞则被视为“背景细胞”,仅具备为神经元提供支持、营养和保护等辅助作用。然而,随着相关研究的深入,这一观点逐渐受到挑战——神经胶质细胞的作用远不止如此。
2023年9月,《自然》杂志刊登的一篇文章首次证实,星形胶质细胞中存在一个特定的亚群,能够通过胞吐作用释放谷氨酸,从而参与神经系统的电信号传导。这一发现颠覆了传统认知,揭示了星形胶质细胞在神经系统中具有重要的生理作用,也为复杂神经性疾病的治疗开辟了新的思路。
01
星形胶质细胞:数量最多且功能最复杂的胶质细胞
1856年,德国病理学家鲁道夫·魏尔肖(Rudolf Virchow, 1821-1902)首次描述了胶质细胞[1],将其视为大脑和脊髓内将神经元连接在一起的结缔组织。胶质(glia)一词源于希腊语中的胶水(glue),这也反映了科学家们对胶质细胞功能最初的理解——将神经元“黏”在一起,编织成严密的神经网络。在人类中枢神经系统内,胶质细胞的数量为神经元的10~50倍,多达1~5x10^12个[2]。与神经元相似,胶质细胞表面也有突起,但并没有树突和轴突之分,彼此之间不能形成化学性突触,而是通过缝隙连接相连。如果将神经元及其突起比作森林,那胶质细胞便是森林中的真菌,包裹着一棵棵树干,交织成网。
事实上,胶质细胞并非单一种类细胞,而是包括多种细胞类型。在中枢神经系统中,胶质细胞主要包括星形胶质细胞(astrocyte)、少突胶质细胞(oligodendrocyte)和小胶质细胞(microglia)等;在周围神经系统中,则主要包括施万细胞(Schwann cell)和卫星细胞(satellite cell)等。
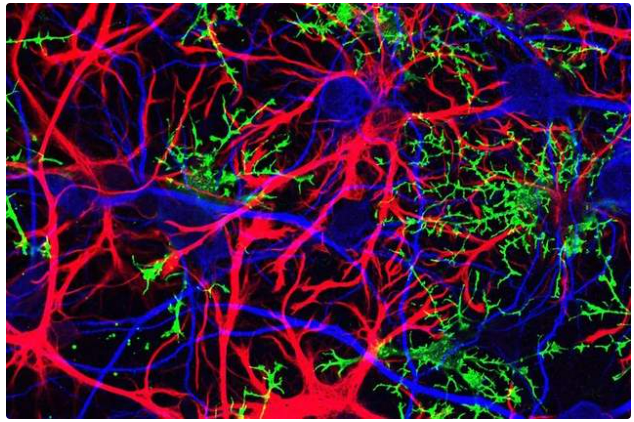
图1. 中枢神经系统荧光显微成像。图中,神经元(蓝色)被大量的胶质细胞包绕,包括星形胶质细胞(红色)和少突胶质细胞(绿色)。| 图源:Jonathan Cohen/NIH
我们今天的主角是星形胶质细胞。星形胶质细胞是中枢神经系统内数量最多、功能最复杂的胶质细胞,是维持神经系统稳态不可或缺的组分,可以说是胶质细胞中的“明星”。
1871年,意大利神经解剖学家及病理学家卡米洛·高尔基(Camillo Golgi,1843-1926,即著名的高尔基体的发现者)发明了著名的铬酸盐-硝酸银染色技术[3],通过显微镜观察到星形胶质细胞的形态,并将其分为两种基本亚型——原生质型(protoplasmic)和纤维型(fibrous)。在传统观点中,前者主要分布于灰质中,突起短粗且分支众多;后者主要分布于白质中,突起长直且分支较少。但这种分类方法显著低估了星形胶质细胞的异质性。事实上,在大脑的不同区域及不同皮质层中,星形胶质细胞都存在转录水平及功能水平上的高度异质性。然而,关于这种异质性是如何形成的,目前尚无定论。
在不同物种中,星形胶质细胞在中枢神经系统中的占比约为20~50%[4]。数量众多的星形胶质细胞与神经元紧密相邻并胶合在一起,它们的长突起在脑和脊髓内交织成网,构成支撑神经元的支架。星形胶质细胞的突起末端膨大,形成血管周足,参与血-脑屏障(blood-brain barrier, BBB)的形成。这些突起包裹着神经元的神经末梢,同时避免不同传入纤维的相互干扰,起到隔离中枢神经系统内各个区域的作用。
除了这些基本功能以外,科学家们发现星形胶质细胞还具有更多复杂的功能。例如,星形胶质细胞能够摄取神经元释放的递质——谷氨酸(glutamate)和γ-氨基丁酸(γ-aminobutyric acid, GABA),并将其转化成谷氨酰胺(glutamine)。这些神经递质可以激活神经元表面的受体,使神经元兴奋,从而实现相邻神经元之间的电信号的传递。而谷氨酰胺无法激活受体,避免了神经元的持续兴奋,还能被转运回神经元内循环利用,为神经元合成新的递质提供原料。
人类大脑约占总体重的2%,却要消耗全身20%的葡萄糖,其中神经元对能量的需求最高,需要持续的葡萄糖供应。星形胶质细胞能摄取血液中的葡萄糖,将其转化为糖原储存,或转化为乳糖来为活跃的神经元供能。这一代谢过程与星形胶质细胞-神经元间的抗氧化物交换系统密切相关,有助于减轻神经元的氧化应激损伤。此外,星形胶质细胞还能产生多种神经营养因子,对神经元的生长、发育、存活和功能完整性具有重要作用。
在发育过程中,星形胶质细胞发挥着引导神经元迁移和修剪突触(synaptic pruning)的作用,调节突触的形成和功能。而它们本身还能作为中枢神经系统内的抗原提呈细胞,将抗原呈递给T淋巴细胞,发挥免疫应答作用。
与神经元不同,胶质细胞终身具有分裂增殖的能力。大脑和脊髓发生损伤变性时,主要依靠星形胶质细胞的增生来填充组织缺损。然而,增生过强可能导致胶质细胞肿瘤的形成,也可能成为引起癫痫发作的病灶。研究表明,在体外能够实现诱导胶质细胞向神经元分化,这为多种神经退行性疾病的治疗提供了希望[5]。但也有学者持相反观点,认为胶质细胞-神经元转化尚无法实现。他们使用谱系追踪技术证实胶质细胞并未转化为神经元,而是某些内源性神经元被错误标记[6]。
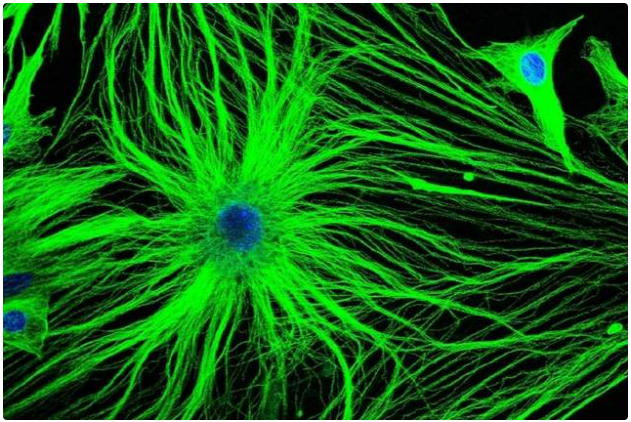
图2. 星形胶质细胞荧光显微成像。| 图源:David Robertson, LCR / Science Photo Library
02
争论不休:星形胶质细胞能否参与电信号传导?
从以上的介绍可以得知,关于星形胶质细胞功能的研究是重要的前沿课题之一,仍有许多未知留待人们探索。这其中就有一个延续了数十年的问题:星形胶质细胞是否参与神经系统的电信号传导。
电信号传导是神经系统正常运作的基础,对维持生命活动、适应环境变化及实现生物体的复杂功能至关重要。电信号传导的异常可能导致多种疾病的发生,包括神经退行性疾病、癫痫和疼痛障碍等。在学界既往的认知里,神经元是神经系统唯一具有电信号传导功能的细胞。有学者认为星形胶质细胞可能参与电信号传导,但始终缺乏一锤定音的证据。
1990年,美国耶鲁大学医学院的研究团队发现[7],在体外培养条件下,谷氨酸能够诱导海马星形胶质细胞内游离钙离子水平的升高。该研究证实星形胶质细胞表面也存在谷氨酸受体,表明其可能参与神经电信号传导。
1994年,美国爱荷华州立大学动物学与遗传学学院的研究团队构建了星形胶质细胞-神经元的体外共培养体系[8],发现在加入缓激肽(bradykinin)后,星形胶质细胞内的钙离子浓度升高,进而诱发谷氨酸释放。释放的谷氨酸通过与神经元表面的谷氨酸受体结合,能引发神经元内钙离子浓度的升高。而在没有星形胶质细胞的孤立神经元培养体系中,缓激肽的加入不会引起神经元内钙离子浓度变化。这表明在体外培养条件下,星形胶质细胞能通过释放谷氨酸向神经元传递电信号。
1997年,来自意大利米兰大学药理学研究所的安德里亚·沃尔泰拉(Andrea Volterra)团队发现反向的结论同样成立[9],即星形胶质细胞能对神经元发出的电信号作出反应。他们使用荧光共聚焦显微镜观察大鼠大脑切片,发现刺激神经元传入纤维能引起星形胶质细胞内钙离子浓度的波动(oscillation),且钙离子浓度波动的频率与神经纤维接收的刺激模式有关。
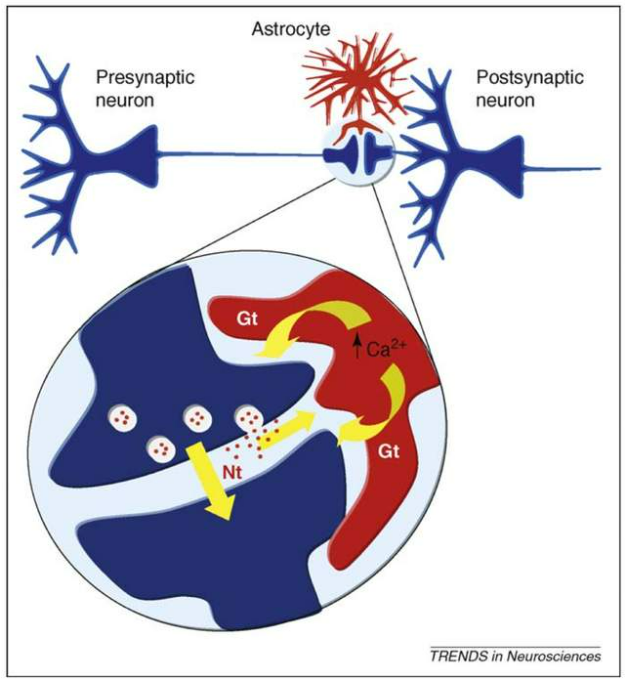
图3. “三重突触”理论示意图。Presynaptic neuron: 突触前神经元;postsynaptic neuron: 突触后神经元;astrocyte: 星形胶质细胞;Ca2+:钙离子浓度;nt(neurotransmitters):神经元释放的神经递质;gt(gliotransmitters):胶质细胞释放的神经递质 | 图源:参考文献[10]
一般理论认为神经元之间信号的传导过程是,突触前神经元释放神经递质,激活突触后神经元表面的受体,引发细胞内钙离子浓度波动,从而兴奋突触后神经元。在发现星形胶质细胞可能参与电信号传导后,便有学者提出了“三重突触”理论(tripartite synapse)[10]。该理论认为,突触处的电信号整合及传导不只涉及突触前端和突触后端,邻近的突触周围星形胶质细胞也参与这一过程。
在2000年至2012年间,该领域发表了超过100篇论文,支持星形胶质细胞通过突触参与神经电信号的传导。但也有反对的声音,质疑数据收集及解释的合理性。反对观点认为,大多数实验是在体外培养的星形胶质细胞中进行的,不能证明星形胶质细胞释放神经递质(gliotransmission)的过程在体内真实发生。
体内实验中,最有力的证据来自于一个星形胶质细胞的囊泡释放受到抑制的转基因小鼠模型。然而在2014年,有学者发现这一在星形胶质细胞研究中广泛应用的小鼠模型存在缺陷[11],导致所有应用此小鼠模型进行的研究可靠性存疑。在此小鼠模型中,研究者使用胶质细胞纤维酸性蛋白(GFAP)启动子来敲除囊泡运输及释放过程中的关键蛋白(SNARE),从而抑制递质释放。既往研究认为,GFAP仅在星形胶质细胞中特异性表达,但后来发现部分神经元也能表达GFAP。因此,该小鼠模型存在“脱靶效应”。敲除SNARE后观察到的生物学效应,不能证明星形胶质细胞递质释放过程在体内存在且具有生理功能,因为该效应可能与部分神经元的递质释放被抑制有关。
正如前文有关星形胶质细胞功能的介绍,大多数学者认同,星形胶质细胞能摄取神经元释放的谷氨酸,从而消除神经递质对神经元的持续作用。但关于星形胶质细胞能否通过释放谷氨酸参与神经元电信号的传导,仍需更直接的证据加以证实。
03
Nature最新研究力证星形胶质细胞参与神经电信号传导
继1997年发现神经元能向星形胶质细胞传递电信号以来,安德里亚·沃尔泰拉(Andrea Volterra)团队一直致力于研究星形胶质细胞-神经元信号交流,并在此领域做出了卓越贡献。2023年9月,《自然》杂志刊登了沃尔泰拉团队的研究论文[12],题为《特化的星形胶质细胞在中枢神经系统中介导谷氨酸能神经递质传递》(Specialized astrocytes mediate glutamatergic gliotransmission in the CNS),为星形胶质细胞参与神经电信号传导提供了强有力的证据。

图4. 沃尔泰拉团队的最新研究论文。| 图源:参考文献[12]
通过对8个小鼠海马单细胞转录组测序开源数据(single-cell RNA sequencing)和对小鼠海马单细胞膜片钳测序数据(patch-seq,一种可以对单个神经元进行电生理学、形态学和转录组学的多模式表征的技术)的整合分析,研究者将小鼠海马星形胶质细胞划分为9个拥有不同分子学特征的亚群,并发现仅其中一个亚群选择性表达与胞吐作用(exocytosis,指细胞内囊泡与细胞膜融合从而将囊泡内物质运送到细胞外的过程,是神经递质释放的重要机制)、钙离子调控胞吐作用(calcium-ion-regulated exocytosis)、神经递质分泌调控(regulation of neurotransmitter secretion)和谷氨酸分泌调控(regulation of glutamate secretion)相关的基因。这就说明该亚群的星形胶质细胞在理论上能够参与电信号传导。而该亚群的星形胶质细胞在小鼠大脑区域内分布不均匀,甚至在特定的神经回路中也非均匀分布。
为了验证人类大脑中是否存在该亚群的星形胶质细胞,研究者在3个人类海马单细胞转录组测序开源数据中搜索他们发现的特异性分子标记物。结果证实,能够释放谷氨酸的星形胶质细胞亚群同样存在于人类海马中。
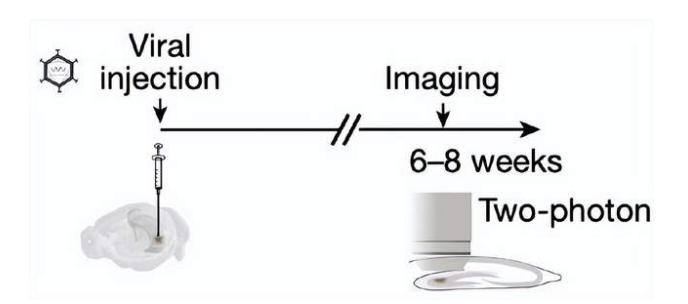
图5. 体外实验示意图。在将病毒载体注入(viral injection)小鼠大脑切片的6-8周(6-8 weeks)以后,研究者使用双光子共聚焦显微镜(two-photon)拍摄星形胶质细胞的图像(imaging)。| 图源:参考文献[12]
单细胞转录组学测序结果引人注目,但仍然只是间接证据。为了直接证实特定星形胶质细胞能够释放谷氨酸,沃尔泰拉团队使用双光子共聚焦显微镜在小鼠大脑齿状回背侧分区(dorsal molecular layer of dentate gyrus,数据预测该区域内富含谷氨酸分泌星形胶质细胞)中观察递质释放。研究者利用在小鼠星形胶质细胞中选择性表达的谷氨酸感受器成像,并在实验体系中添加了突触释放阻滞剂,以排除神经元递质释放干扰。为了模拟体内由G蛋白偶联受体(G protein-coupled receptors, GPCR)介导的钙离子浓度依赖谷氨酸递质释放过程,研究团队在实验小鼠星形胶质细胞中表达了由氮-氧氯氮平(clozapine N-oxide, CNO)激活的GPCR受体。在小鼠大脑切片局部加入CNO后,他们在一部分星形胶质细胞中观察到了谷氨酸递质的释放,并发现这部分星形胶质细胞聚集在特定区域,被称为谷氨酸释放“热点”(hotspot)区域。通过向小鼠大脑切片内注射病毒载体,研究者在小鼠星形胶质细胞中特异性敲除了囊泡谷氨酸转运体1(vesicular glutamate transporter 1, VGLUT1)。实验发现,敲除VGLUT1后无法在“热点”区域观察到CNO诱发的谷氨酸递质释放,证明星形胶质细胞递质释放是由胞吐作用介导的。
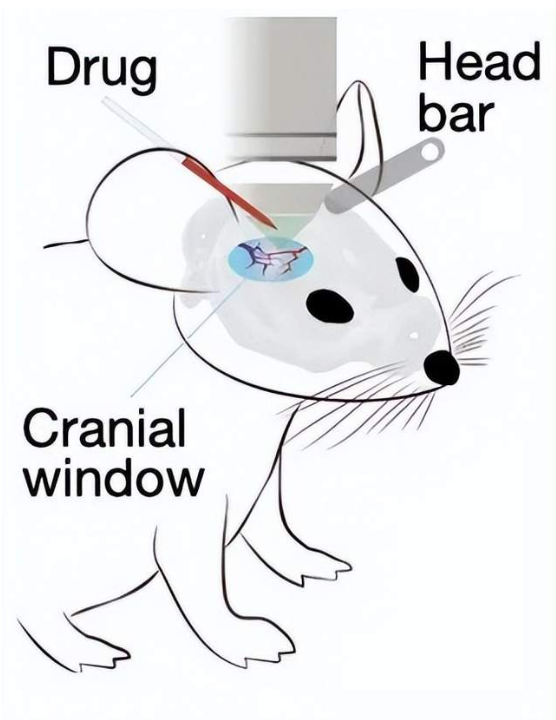
图6. 体内实验示意图。Two-photon: 双光子共聚焦显微镜;head bar:用于固定小鼠头部的杆子;cranial window:颅窗,用于注射药物;drug:实验用药。| 图源:参考文献[12]
上述实验是在体外进行的,为了证实星形胶质细胞递质释放过程能在体内发生,研究者打开小鼠颅骨,使用双光子共聚焦显微镜观察清醒小鼠初级视觉皮层内的谷氨酸释放。在未加药物刺激时,他们记录到了内源性星形胶质细胞谷氨酸释放信号,说明星形胶质细胞能够感知自然状态下细胞外间隙中的谷氨酸浓度波动。在CNO的刺激下,星形胶质细胞谷氨酸释放频率显著增加。
此外,研究者还进行了功能实验,证明VGLUT1依赖的星形胶质细胞递质释放对急性癫痫发作具有保护作用;而VGLUT2依赖的星形胶质细胞信号通路具有调节黑质-纹状体回路的功能,是帕金森病的潜在治疗靶点。
沃尔泰拉团队通过单细胞测序技术找出了能释放谷氨酸的星形胶质细胞的分子特征,又通过体内和体外实验直接观察到了星形胶质细胞递质释放过程,还用功能学实验展示了星形胶质细胞递质释放在神经疾病中的潜在保护作用。星形胶质细胞的电传导功能领域,终于迎来了一锤定音的证据。同时,研究结果也为过去三十多年相互矛盾的研究提供了解释。由于仅特定亚群的星形胶质细胞能够释放谷氨酸,既往研究得出的结论是与星形胶质细胞的取材密切相关的:如果研究者使用的星形胶质细胞并非该特定亚群,就无法观察到谷氨酸释放。

图7. 沃尔泰拉的近照。继沃尔泰拉首次发现体外培养的星形胶质细胞能对神经元电信号作出反应,已经过去了25年。这一次,他带来了新的重磅证据。| 图源:Andrea Voltera
在接受采访时,沃尔泰拉表示:“我们是正确的,确实存在能释放谷氨酸的星形胶质细胞。但我们也是错误的,因为我们原以为所有星形胶质细胞都能释放谷氨酸。”[13]英国伦敦大学学院(University College London)的神经科学教授德米利特·卢萨科夫(Dimitri Rusakov)对此评论道:“几乎可以肯定地说,这些发现颠覆了目前学界对大脑信号传导方式的理解,但具体是以何种方式颠覆,仍是一个开放性问题。”
04
好的研究会带来更多问题
证实星形胶质细胞能释放谷氨酸递质仅仅是第一步,未来仍有许多问题等待我们解答。星形胶质细胞释放的谷氨酸递质对神经突触有何影响?哪些大脑功能需要星形胶质细胞的参与?为何大脑中只有特定区域富含谷氨酸能星形胶质细胞?
当然,要回答这些问题也有一些技术层面的问题要解决——如何更好地标记星形胶质细胞。理想的星形胶质细胞标记物(分子)应该是稳定的,能够特异性标记该类细胞,且在每个细胞中表达水平相似。现有的标记物都有各自的不足,比如GFAP(参与细胞骨架组装的蛋白)在不同细胞间的表达水平差异较大,且在疾病或损伤状态下表达水平会发生剧烈变化。而ALDH1L1(一种代谢酶)表达水平相对稳定但非常低,难以通过免疫荧光/免疫组化方式进行检测,且该蛋白在肝脏细胞内也有较高的表达水平。完美的细胞特异性标记物的缺乏,给星形胶质细胞的研究带来了较大的阻碍。
一项卓越的科学研究,在解答问题的同时,也会引发无数新的疑问。数量庞大的星形胶质细胞蕴含了无限可能性,吸引了一批批科学家投身其中。正如卢萨科夫所说,“我们已经积累了大量的证据,现在需要的是一个能将所有证据整合到一起的理论。”
参考文献
[1] Virchow, R. (1856). Gesammelte Abhandlungen zur Wissenschaftlichen Medizin. Meidinger Sohn & Co.
[2] 吴江等.《神经病学》,人民卫生出版社,2015年6月第3版
[3] Golgi, C. (1871). Contribuzione alla fina Anatomia Degli Organi Centrali del Sistema Nervosos. Tipi Fava e Garagnani.
[4] Hasel, P. (2021). Astrocytes. Current Biology, 31(7):R326-R327.
[5] Wu, Z. (2020). Gene therapy conversion of striatal astrocytes into GABAergic neurons in mouse models of Huntington's disease. Nature Communications, 27;11(1):1105.
[6] Wang, LL. (2021). Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell, 184(21):5465-5481.e16.
[7] Cornell-Bell, AH. (1990). Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science, 247(4941):470-3.
[8] Parpura, V. (1994). Glutamate-mediated astrocyte–neuron signalling. Nature, 369, 744–747.
[9] Pasti, L. (1997). Intracellular calcium oscillations in astrocytes: a highly plastic, bidirectional form of communication between neurons and astrocytes in situ. Journal of Neuroscience, 17(20):7817-30.
[10] Perea, G. (2009). Tripartite synapses: astrocytes process and control synaptic information. Trends in Neuroscience, 32(8):421-31.
[11] Sloan, SA. (2014). Looks can be deceiving: reconsidering the evidence for gliotransmission. Neuron, 17;84(6):1112-5.
[12] de Ceglia, R. (2023). Specialized astrocytes mediate glutamatergic gliotransmission in the CNS. Nature, 622(7981), 120-129.
[13] https://www.quantamagazine.org/these-cells-spark-electricity-in-the-brain-theyre-not-neurons-20231018/
本文受科普中国·星空计划项目扶持
出品:中国科协科普部
监制:中国科学技术出版社有限公司、北京中科星河文化传媒有限公司
特 别 提 示
1. 进入『返朴』微信公众号底部菜单“精品专栏“,可查阅不同主题系列科普文章。
2. 『返朴』提供按月检索文章功能。关注公众号,回复四位数组成的年份+月份,如“1903”,可获取2019年3月的文章索引,以此类推。
版权说明:欢迎个人转发,任何形式的媒体或机构未经授权,不得转载和摘编。转载授权请在「返朴」微信公众号内联系后台。
来源: 返朴


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 返朴
返朴 
