生命起源于一颗受精卵。精子“翻山越岭”遇见卵子的能力,是生命发生的必要条件。如果精子的运动能力出现异常,自然受孕的成功率便会大大降低;当精液中精子向前运动的比例低于32%时,则被定义为“弱精症(asthenozoospermia)”。这是目前男性不育的常见病因。北京时间2023年6月8日,西湖大学生命科学学院、西湖实验室吴建平团队与浙江大学桂淼团队和南京医科大学刘明兮团队合作,在Cell在线发表题为“Structures of sperm flagellar doublet microtubules expand the genetic spectrum of male infertility”的文章(图1),首次解析了小鼠和人的精子鞭毛微管二联体复合物的冷冻电镜结构,鉴定了多个精子特异的微管结合蛋白,并由此发现了一类新型的弱精症亚型。该工作为理解精子运动的结构基础以及相关男性不育症的诊断和治疗提供了重要线索。 图1:文章截图
图1:文章截图
原文链接:https://doi.org/10.1016/j.cell.2023.05.009
从精子运动的“发动机”说起受精过程,道阻且长。
承担精子运动主要动力的鞭毛,是一种细长而弯曲、具有运动功能的细胞器,存在于精子或者一些单细胞生物上。比如气管纤毛可以帮助人体排出气管内的废物;衣藻鞭毛可以带动衣藻在水中游动;精子努力向卵子游动,靠的就是精子鞭毛的规律性摆动。
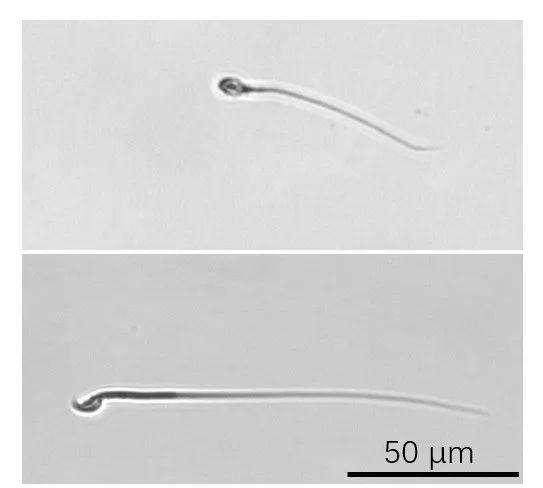
图2:人的精子(上)和小鼠精子(下)的照片
如果说精子是一辆“汽车”,那么鞭毛就是汽车的“发动机”,一旦“发动机”出了故障,“汽车”便无法启动。可以预见,鞭毛的结构中很可能蕴含着理解精子运动的重要线索。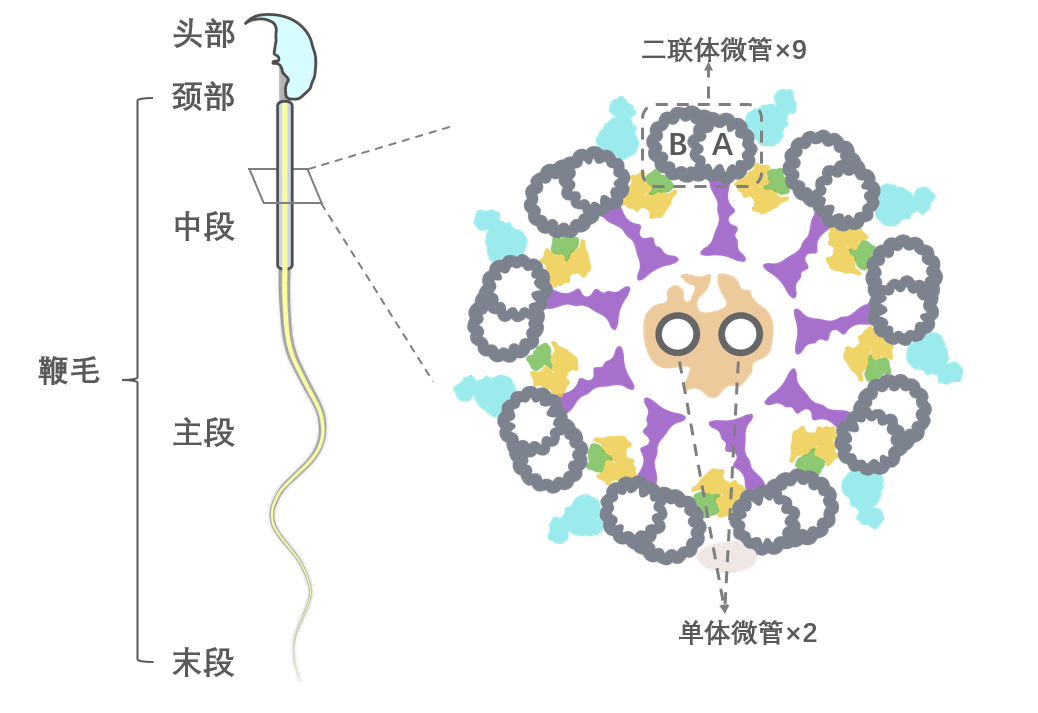
图3:精子结构示意图及其轴丝横截面示意图
从上图(图3)我们可以看到,鞭毛通常被分为颈部、中段、主段和末段,其主体的中央贯穿着一个巨大的分子机器——轴丝。在轴丝的横切面可以观察到9个微管二联体环绕着中央2个单体微管,即经典的“9+2”结构。这个“9”很重要,它们就像混凝土中的钢筋一样,对鞭毛起到支撑作用。但它的结构却一直是个谜。由此,研究团队把目光聚焦在“微管二联体”上。在精子鞭毛的运动中,它扮演着什么样的角色?是否存在一些特异的组成和结构特征,决定或影响了鞭毛的运动能力?在小鼠和人类精子鞭毛中寻找蛛丝马迹结构决定功能。为了解答上述疑问,研究团队分别解析了小鼠(图4)和人类精子的微管二联体结构,在分辨率更高的小鼠精子微管二联体中共鉴定了多达49个不同的蛋白组分。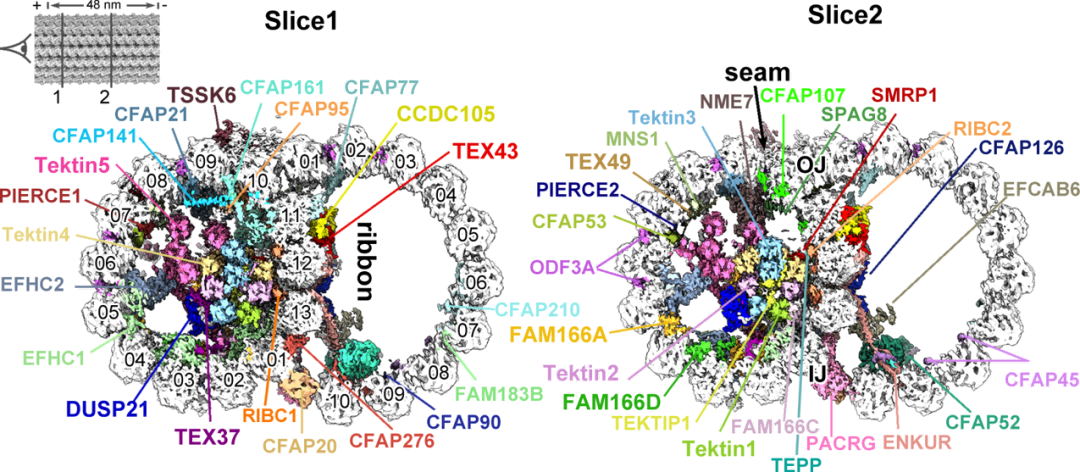
图4:小鼠精子微管二联体高分辨率结构
他们发现,与已有的牛的气管纤毛微管二联体结构比较,除了一种FAM166B蛋白,其他在牛的气管纤毛微管二联体中的微管腔内结合蛋白(Microtubule inner protein,MIP)均存在于小鼠精子鞭毛中。不同的是,他们在小鼠精子微管二联体中鉴定到了额外的10种精子特异的MIP蛋白,包括一个去磷酸化酶DUSP21。在小鼠精子微管二联体的外部区域,还发现了一个蛋白激酶TSSK6的结合。这表明小鼠精子鞭毛微管二联体相比其他鞭毛系统的微管二联体组成更加复杂,可能帮助进一步稳定精子鞭毛结构,以适应其剧烈摆动的功能。然后对比人类精子鞭毛微管二联体与小鼠精子微管二联体(图5),前者体内也拥有大部分MIP蛋白,包括新鉴定的多种精子特异MIP蛋白,两者的差别仅仅是人类精子内缺少了一种DUSP21蛋白,以及小鼠精子特异的MIP蛋白Tektin5和FAM166A的拷贝数在人精子微管二联体中有所减少。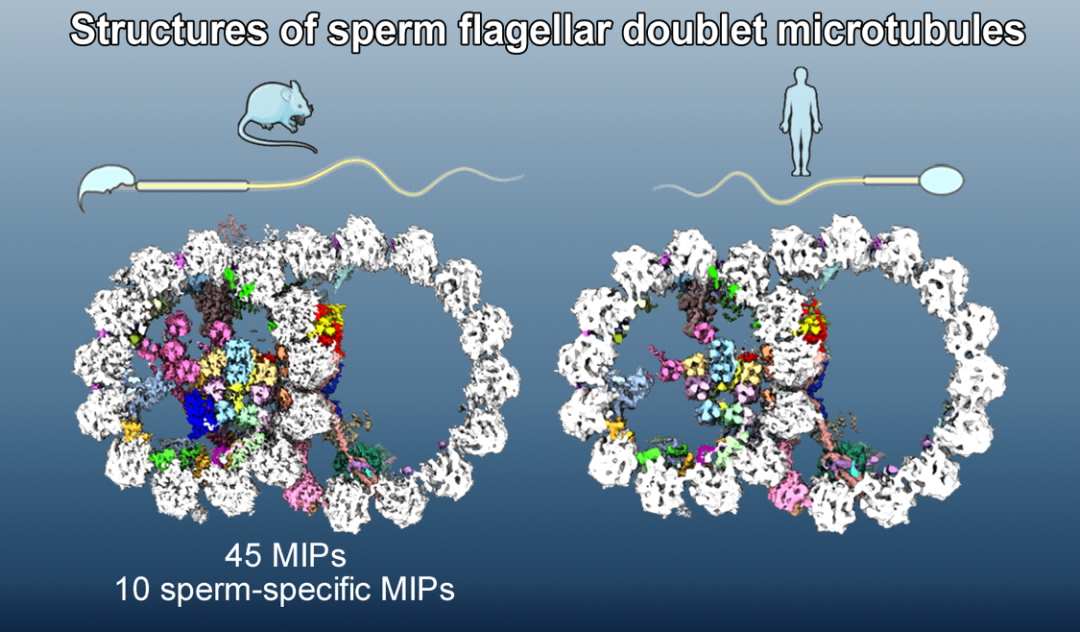
图5:小鼠与人精子微管二联体结构比较
至此,研究团队已经较为清晰地看到了精子微管二联体在不同物种之间的差异性,他们大胆预测,这些精子中独有的MIP蛋白可能会对精子鞭毛的稳定性和精子运动调控发挥重要的作用。也就是说,从结构表明,“MIP蛋白”是影响“发动机”性能好坏的关键部件。发现10种MIP蛋白的突变在男性不育的过往研究中,对精子鞭毛因为“形态异常”而导致的弱精症研究相对较多(multiple morphological abnormalities of the sperm flagella,MMAF),MMAF患者的精子鞭毛在外观上就与正常精子鞭毛“长得不一样”。但在这一类弱精症患者的基因筛查中,并没有检测到MIP蛋白有异常。这与研究团队的判断似乎并不相符。但微管二联体在精子鞭毛结构中的重要作用毋庸置疑,MIP蛋白发生突变不可能不对精子活动造成影响,问题究竟在哪里?如果这类弱精症患者中没有找到MIP蛋白突变,那是不是从一开始就搞错了“对象”?MIP蛋白突变可能会导致另一种已经存在却还未被发现的弱精症?大胆假设、小心求证,科学研究就是在一次次的猜想-论证-再论证的过程中不断前进。研究团队募集了281位非MMAF的男性不育患者,这些患者的精子形态看起来与正常人没有区别,但是精子的运动功能异常,无法完成正常受精。通过对这些患者进行外显子测序分析,研究团队果然发现其中32位患者携带了与MIP蛋白相关的突变,这些病例涵盖了10种MIP蛋白(图6),共涉及到17种突变形式,其中8种MIP蛋白是首次发现与男性不育症有关。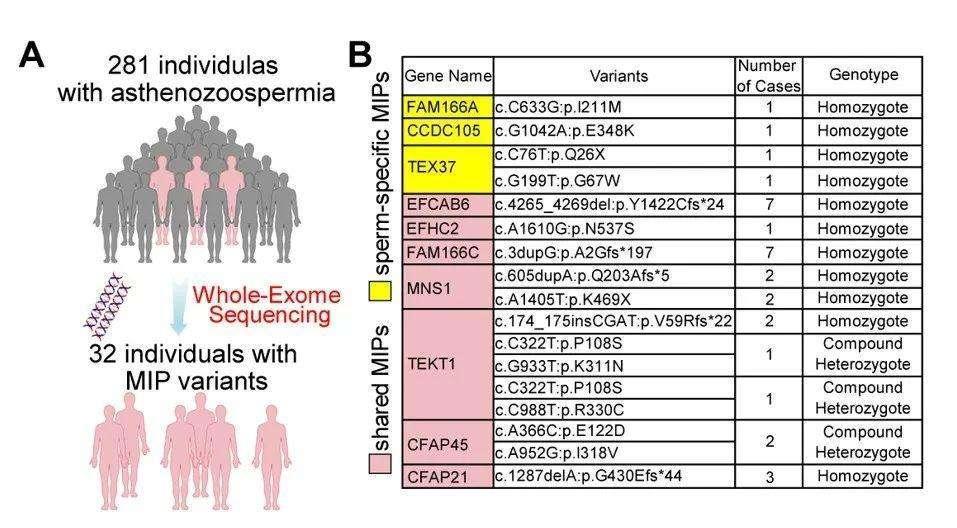
图6:临床鉴定MIP突变的流程图和32位MIP相关的弱精症患者概览
进一步分析,研究团队发现这些突变位点在精子微管二联体中的分布较为分散,这表明微管二联体内不同区域的异常都可能导致自身结构破坏,进而引起精子功能异常。由此,研究团队提出了一类新型弱精症亚型,称为“MIP突变相关弱精症(MIP variants-associated asthenozoospermia,简称MIVA)”。这类弱精症患者的精子共同特征是精子运动能力受损,鞭毛摆动异常,轴丝结构受损,但形态无明显的缺陷。这一研究结果为我们理解不同物种和组织中微管二联体的特异性以及深入研究和理解精子鞭毛的功能和调控奠定了重要基础,为相关的男性不育症的诊断提供了新的思路,并为潜在的治疗干预提供了新的途径。“逆向而行”的探索之路“从疾病的基因检测入手,找到相关突变蛋白,解析结构了解其功能机制,这是十分经典的‘自下而上’的研究路径。但是有时候,这样的研究思路无法系统性、全局的理解研究对象。”吴建平说。这一次,他们“自上而下”,先从相对宏观的分子机器结构入手,一步步缩小包围圈,再从中找到疾病相关突变蛋白,并最终验证了突变蛋白与疾病的关联性。这样不仅看清了特定蛋白与其他蛋白的结构和关联,对于蛋白参与生理活动的过程一目了然,而且帮助他们获得多维度的信息,更快、更精准地实现突破。逆向而行、大胆创新,或许这正是这位90后科学家在继2021年解密精子活化开关CatSper通道体后,在精子结构领域再次取得突破的关键因素之一!西湖大学2020级博士研究生周伦妮、刘浩滨和南京医科大学博士研究生刘思钰为本文共同第一作者。西湖大学/西湖实验室特聘研究员吴建平、浙江大学良渚实验室/附属邵逸夫医院研究员桂淼和南京医科大学生殖医学与子代健康全国重点实验室教授刘明兮为本文共同通讯作者。该研究得到西湖大学冷冻电镜平台、高性能计算平台、质谱平台和动物中心的大力支持。
来源: 科技导报


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 桂粤科普
桂粤科普 