出品:科普中国
制作:李娟
监制:中国科普博览
大脑可以说是我们人体最重要的器官。我们执行思考、学习、沟通、运动、解决问题、做出决定等能力,都离不开这个生理基础。经过长年进化,大脑建立了一个强大的防御系统来自我保护。
第一层防御“盔甲”是头骨,其次是覆盖大脑的脑膜,之后是具有缓冲作用的脑脊液。另一个重要的“护卫军”也不容忽略,它就是本文要谈到的血脑屏障(Blood–Brain Barrier,BBB)。
血脑屏障是血流和大脑细胞之间的“城墙”,对大脑稳态的维持至关重要。它只允许一小部分物质穿过血液进入脑组织,比如水、氧气和小的脂溶性物质,而阻止毒素、病原体和其他潜在危险物质的进入。
但与此同时,治疗脑部疾病的药物也很难跨越这层壁垒而发挥作用。研发人员正在尝试多种策略,以攻克这一神经疾病的治疗难题。
“密不透风”的血脑屏障
作为捍卫大脑的“城墙”之一,血脑屏障肯定有“过人之处”,这首先体现在血管组织的结构上。
与身体的外周血管不同,血脑屏障中的血管内皮细胞具有特别的结构——紧密连接(Tight junction):各种分子在相邻的细胞膜内外“穿针引线”,将血管内皮缝得“密不透风”。而身体其他部位的血管内皮则存在小间隙,允许小的血源性物质穿过并进入周围组织(图1)。
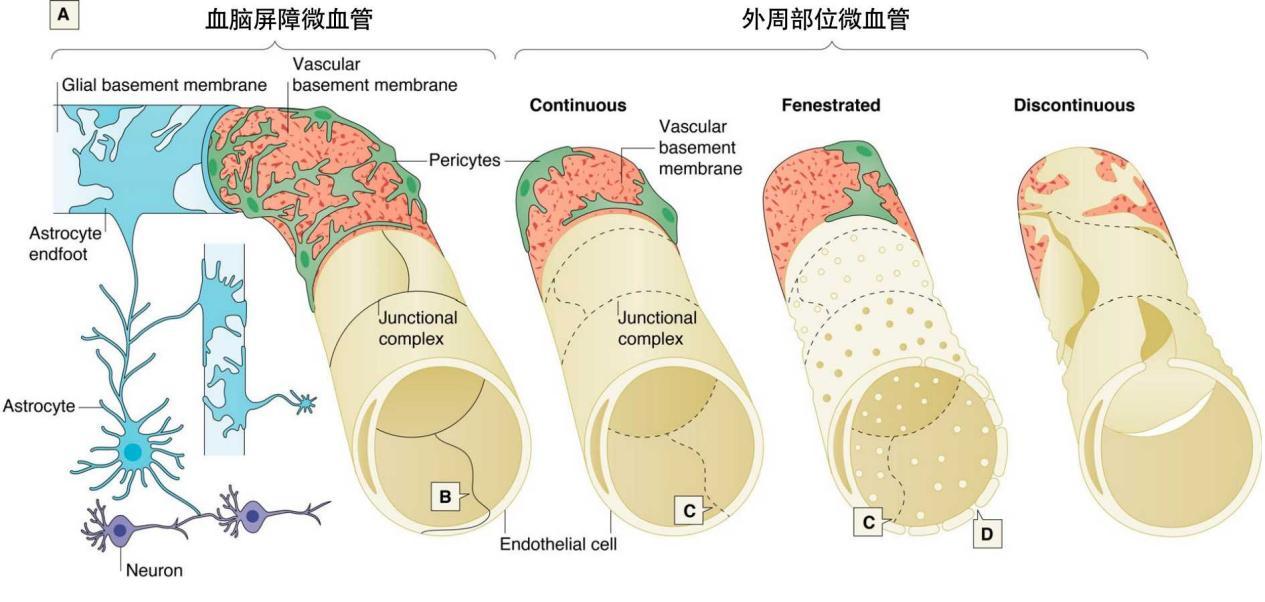
图1 血脑屏障中的微血管与外周部位血管的结构的比较
(图片来源:参考文献2)
除了血管内皮细胞(Endothelial cell),血脑屏障功能的发挥还依赖于星形胶质足突(Astrocyte)、周细胞(Pericytes)(图2)。

图2 脑部微血管结构
(图片来源:参考文献2)
其中,星形胶质细胞的足突占脑毛细血管近99%的管腔表面积,延伸到血管壁。周细胞嵌入血管基底膜中,与内皮细胞有物理连接。周细胞有助于维持和稳定大脑中内皮细胞的单层,并且对于紧密连接的发展至关重要。
这三类细胞的互相作用使得血脑屏障成为一个动态界面,以调节大脑稳态、保护中枢神经,并对不同的生理和病理状态做出反应。
血脑屏障如果出现功能障碍,可能会导致水肿、信号改变、离子稳态破坏和免疫外渗,进而导致神经元功能失调,并最终导致神经细胞退化。癫痫、缺血性中风、多发性硬化症、外伤性脑损伤和阿尔茨海默病等疾病,均以血脑屏障受损为特征。可见,血脑屏障的作用极其重要。
你再这么保护你的“宝”,我们就保护不了它了!
虽然血脑屏障可以很好地保护大脑,但在中枢神经系统疾病的治疗中,药物必须跨越血脑屏障,递送至脑实质,这是药效得以最大发挥的基础。
2019年,首个跨越血脑屏障的生物制剂Zolgensma获得FDA批准。这是一种基于腺相关病毒AAV9的基因疗法,用于治疗婴儿脊髓性肌萎缩症(SMA)-1。通过静脉注射的给药形式,Zolgensma将功能性SMN1基因递送至患者体内,促进SMN蛋白的表达,从而恢复患者受损的运动神经元。
然而,除了此类基因治疗,在神经疾病药物试验领域的成功案例少之又少。最近的报告表明,由于脑渗透性差,只有不到10%的用于神经疾病的治疗剂进入临床试验。
血脑屏障为何难以突破?
这是因为它所构建的“铜墙铁壁”只允许亲脂性和低分子量(低于400~500Da)的分子通过跨细胞途径从血流进入大脑。在这种情况下,约98%的小分子药物和几乎100%的大分子生物药物(如单克隆抗体、反义寡核苷酸或病毒载体)都无法通过血脑屏障。
早前,那他珠单抗被FDA批准用于治疗多发性硬化症,但该单抗也无法穿过血脑屏障,而是通过阻断淋巴细胞穿过脑内皮壁的运输起作用。2009年,FDA批准贝伐珠单抗用于复发性胶质母细胞瘤的成人患者,但这种单抗并不能穿过未损坏的血脑屏障而起作用。
虽然近些年生物制药行业发展得如火如荼,但FDA批准的用于治疗老年性脑部严重疾病(例如阿尔茨海默病、帕金森病)的生物制剂少之又少。
在过去的25年中,多种进入临床试验的生物制剂缺乏血脑屏障递送技术,只能实施破坏血脑屏障,或者将药物注射到大脑或脑脊液的“血脑屏障回避策略”。其试验结果通常都是无效的,除了极少数情况,大多数临床试验均可预见地失败了。
为了掩血脑屏障的耳目,科学家太难了
有学者强调,脑药物的研发应该并行推进两个方面,一个是脑药物的研发,另一个就是能够跨越血脑屏障的药物输送技术的研发,尤其是基于血脑屏障自身转运机制的技术。
目前来看,脑药物的递送策略大致分为侵入性技术和非侵入性技术(图5)。

图5 脑部药物递送策略。
(图片来源:参考文献3)
侵入性技术包括使用有害药物、高渗溶液、超声或电穿孔来短暂性地破坏血脑屏障、侧脑室或鞘内输注等。
非侵入性技术包括基于生物学机制(比如载体或受体介导的转运途径)的新药研发、纳米颗粒系统的研发、聚焦超声的应用,以及鼻内脑给药的使用等。
相比侵入性技术,非侵入性的无创技术更易被接受并推广。其中,基于血脑屏障自身生物学转运机制的技术研发是重中之重。
下图(图6)列出了多种跨越血脑屏障的转运机制,比如转胞吞机制或细胞迁移。其中,转胞吞作用是通过形成囊泡在细胞之间转运“货物”的过程。简单来说,药物可以通过以下方式跨越血脑屏障:
通过吸附介导的转胞吞作用,形成囊泡将药物转运到大脑;
通过载体结合的转胞吞作用,将药物分子与载体结合进而跨越屏障;
通过受体介导的转胞吞作用,可将药物蛋白质分子、抗体或肽与受体结合,触发内吞形成囊泡运送到大脑——这也是研究最广泛的脑递送治疗剂途径;
通过细胞迁移的机制,单核细胞或巨噬细胞能够转胞吞或穿过细胞间隙达到大脑,再分泌或释放其中的蛋白质或类病毒颗粒药物。
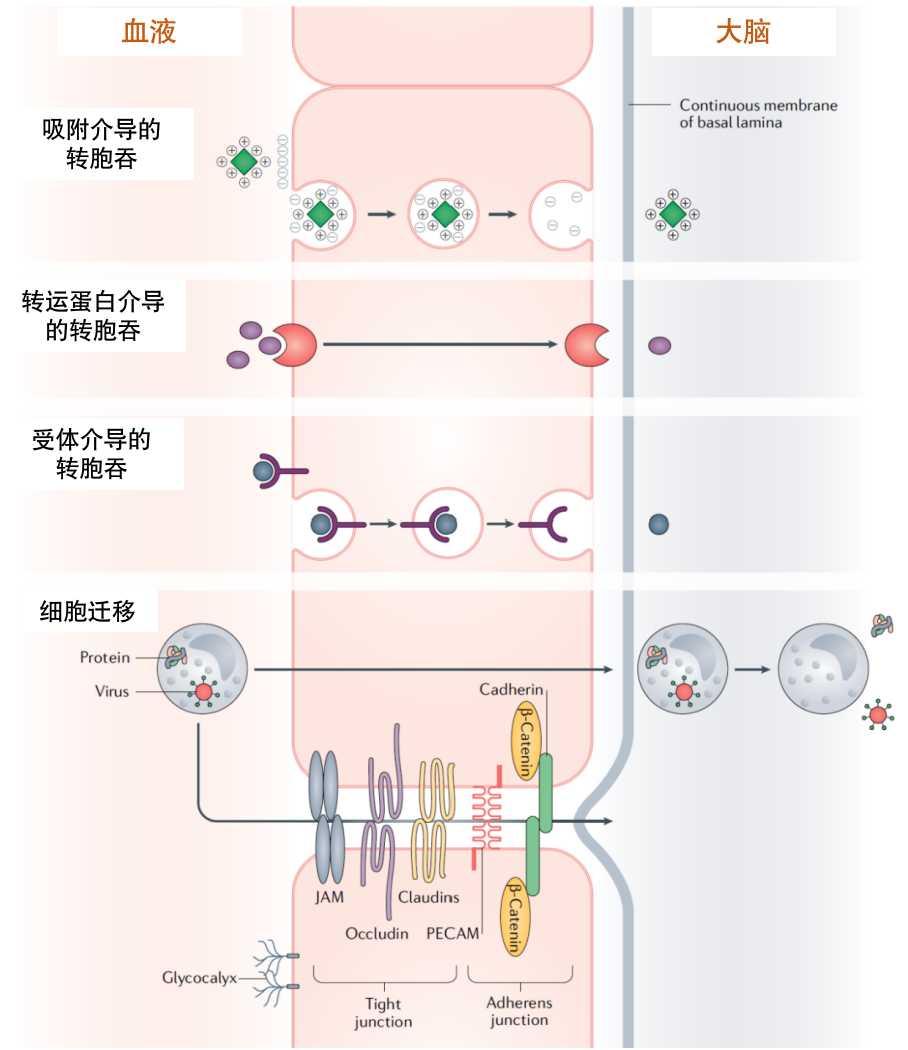
图6 跨越血脑屏障的生物学转运机制
(图片来源:参考文献3)
当下,科学家还需要做更多的工作来准确理解血脑屏障的生物学机制,从而助力神经系统疾病治疗靶点的发现,并确定药物递送的治疗策略。
随着分子技术、成像模式和纳米技术的快速发展,相信包括医学、化学、生物工程和电子学在内的各种学科的知识网络将使科学家能够克服血脑屏障带给神经疾病治疗的挑战。
(注:文中图片基于所标注参考文献的原图做了中文翻译。)
参考文献:
[1] Kadry, H., Noorani, B. & Cucullo, L. A blood–brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS 2020 17, 69.
[2] Profaci CP, Munji RN, Pulido RS, Daneman R. The blood-brain barrier in health and disease: Important unanswered questions. J Exp Med. 2020. 217(4):e20190062.
[3] Terstappen GC, Meyer AH, Bell RD, Zhang W. Strategies for delivering therapeutics across the blood-brain barrier. Nat Rev Drug Discov. 2021. 20(5):362-383.
[4] Sweeney MD, Zhao Z, Montagne A, Nelson AR, Zlokovic BV. Blood-Brain Barrier: From Physiology to Disease and Back.Physiol Rev. 2019. 99:21-78.
[5] Pardridge WM. Blood-Brain Barrier and Delivery of Protein and Gene Therapeutics to Brain. Front Aging Neurosci. 2020. 11:373.
[6] Terstappen, G.C., Meyer, A.H., Bell, R.D. et al. Strategies for delivering therapeutics across the blood–brain barrier. Nat Rev Drug Discov 2021 20, 362-383.
(注:文中拉丁文部分应为斜体。)

来源: 中国科普博览
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 中国科普博览
中国科普博览 
