“参考电极”又称“参比电极”。在测定一个电极的电极电位时,必须另配上一个已知电极电位电极使成为一个电池,测其电势后,方可算出被测电极的电极电位。这样配上的已知电极电位的电极,称为参考电极。如氢电极等。1
基本概述“参考电极”又称“参比电极”。由于单个电极的电极电位无法直接测出,所以在测定一个电极的电极电位时,必须另配上一个已知电极电位的电极,使成为一个电池。在测定此电池的电动势后,才可以标出被测电极的电极电位。此种配上的已知电极电位的电极,称为“参考电极”。一级参比电极的电极电位 一般取为零。以标准氢电极(SHE)为一级参比电极而测出的电极电位称为“氢标电极电位”或标准电极电位。常用的二级参比电极有甘汞电极与氯化银电极,它们的氢标电极电位均已精确测定,因此欲测电极与它们配对组成电池后,可以很方便地由测定的电池电动势算得它的氢标电极电位。汞电极是另一种一级参比电极, 它规定电极上的电荷相对于溶液为零时的 电极电位为零,以之测得的电极电位称为 “绝对电位”,这种电极较少应用。2
标准氢电极氢电极由氢气吸附在金属铂表 面而构成。为了增加氢的吸附率和增大电极表面积,在 铂上镀以铂黑(即高分散度的铂)。具体说,实验室中使用的氢电极是这样制作的:将1平方厘米正方形铂片(或铂黑)与一根铂丝相焊接,然后将大部分铂丝封结在玻璃 套管中。铂丝上端在使用中露出液面,以便进行电连 接。将上述铂电极放入盛有酸性或碱性溶液的一粗玻璃管中,并向管中通入纯氢气,即构成氢电极。如图1所示。
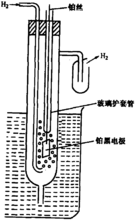
氢电极上的电极反应为:
酸性溶液中 2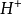 +2e⇌H2
+2e⇌H2
碱性溶液中 2H2O+2e⇌H2+2OH
氢电极的电极电位与溶液的pH值、氢气压等有 关。令标准氢电极所处溶液的pH值等于零(即氢离子活度等于1)、氢气的压力为101325Pa(即1atm)。在以上标准条件下,标准氢电极的电极电位等于零,其数值与溶液温度无关。3
饱和甘汞电极饱和甘汞电极由甘汞电极由汞、甘汞和KCl溶液等构成。在电极内部有一根小玻璃管,管内的上部放置汞,它通过封在玻璃管内的铂丝与外部的导线相通。 汞的下面放置汞和甘汞生成的糊状物。为了防止其下落,小玻璃管下部用脱脂棉花塞住。将小玻璃管浸在 KCl溶液中。甘汞电极的下端用多孔性陶瓷封口,以减缓溶液的流出速度。

甘汞电极的电极反应为:
Hg2Cl2+2e⇌2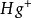 +2
+2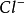
可见,甘汞电极的电极电位与溶液中氯离子浓度有关。饱和甘汞电极内的溶液采用饱和KCl溶液, 其电极电位等于0.2415V(SHE,25℃),当KCl的摩尔浓度为1mol/L,其电极电位为0.2801V(SHE,25℃),这种电极具有稳定的电极电位,结构简单、制作容易等优点,在实验室试验中得到了广泛应用。饱和甘汞电极的缺点是其电极电位对温度十分敏感,尤其在温度下降时滞后现象很严重,重新达到平衡要很长时间。3
银-氯化银电极银-氯化银电极由一根表面涂 复有AgCl的螺旋状银丝浸入含有Cl离子的溶液中 构成,如图3所示。
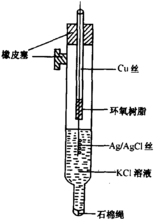
银-氯化银电极的电极反应为:
AgCl+e⇌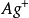 +
+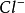
在0.1mol/L的KCl溶液中,Ag/AgCl电极的电极电位等于0.2880V(SHE,25℃),银-氯化银电极的电极电位稳定,重现性好,而且结构简单,使用方便,因此除在实验室中应用外还广泛用于船舶阴极保护。3
铜-硫酸铜电极铜-硫酸铜电极由一根铜棒 插在饱和硫酸铜溶液中构成,如图4所示。
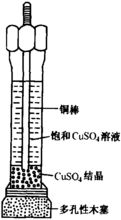
铜-硫酸铜电极的电极反应为:
CuSO4+2e⇌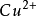 +
+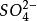
在饱和硫酸铜溶液中,Cu/CuSO4电极的电极电 位等于0.3160V(SHE,25℃)。铜-硫酸铜电极结构简单,制作容易,坚固牢靠,是一种工业应用的简易参比电极。钢构筑物在土壤中实施阴极保护时常采用 Cu/CuSO4电极进行电位监控。3
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

