混合物中溶质B的物质的量与混合物各组分物质的量之和的比值,称为摩尔分数(mole fraction),用符号xB表示。
xB=nB/n
式中:xB表示溶质B的摩尔分数,单位为1;nB表示溶质B的物质的量,单位为mol;n为混合物的物质的量,单位为mol。
显然,溶液中各组分摩尔分数之和等于1,即∑xi=1。
定义摩尔分数是指混合物中物质B的溶质的量nB与混合物的总物质的量n之比,用符号xB表示,摩尔分数的SI单位为1,即没有单位。
即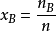
若溶液由A和B两种组分组成,溶质物质的量为nB,溶剂的物质的量为nA
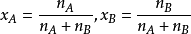 显然溶液各组分物质的摩尔分数之和等于1。1
显然溶液各组分物质的摩尔分数之和等于1。1
设某溶液中有组分数i,n1、n2、n3……ni表示溶液中各组分的物质的量,XB表示组分B的摩尔分数则:
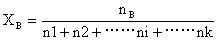
故 xA+xB+···+xi=nA/n+nB/n+···+ni/n=nA+nB+···+ni/n=n/n=1
简写为: 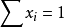
质量分数w和摩尔分数x的换算(以双组分为例)
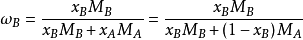
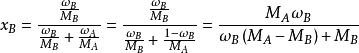
如需溶液将体积分数转换成摩尔分数,需要先用密度换算质量分数再用上面公式,而对于同一状态,由于道尔顿分压定律,气体压强分数等于摩尔分数等于体积分数。
影响因素由其定义表达式可知,摩尔分数影响因素只能是某物质的物质的量以及总的混合物的物质的量,温度、压力、状态等因素均不影响摩尔分数的大小。
示例例 2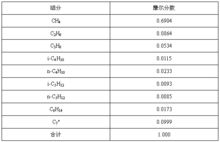
某乙醇溶液含水2mol,含乙醇3mol,求乙醇和水的摩尔分数?
解:x水=n水/【n水+n乙醇】=2mol/【2mol+3mol】=0.4
x乙醇=n乙醇/【n水+n乙醇】=3mol/【2mol+3mol】=0.6
本词条内容贡献者为:
李勇 - 副教授 - 西南大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

