沉淀在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变( 或一定) ,其离子浓度幂的乘积为一个常数,这个常数称之为溶度积常数,简称溶度积。
溶度积与溶解度都可以表示难溶电解质的溶解性,但二者也有差异。
溶度积的定义及来源沉淀在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变( 或一定) ,其离子浓度幂的乘积为一个常数,这个常数称之为溶度积常数,简称溶度积,用 表示.
表示.
在一定的的温度下,将难溶的强电解质放入水中,就会发生沉淀和溶解两个过程。例如:将硫酸钡放入水中,硫酸钡是由硫酸根离子和钡离子组成的晶体,将其放入水中,晶体中的钡离子和硫酸根离子在水分子的作用下,不断地由晶体表面进入到水中,成为无规则运动的水合离子,这就是硫酸钡晶体的溶解过程;同时,已经溶解在溶液里的硫酸根离子和钡离子在不断运动中相互碰撞或者与未溶解硫酸钡表面碰撞,以固体硫酸钡的形式析出,这是硫酸钡的沉淀过程。任何难溶电解质的沉淀和溶解过程都是相互可逆的。开始时,溶解速率较大,沉淀速率较小,在一定的条件下,沉淀溶解的速率相等时,此时建立起了多相离子的平衡状态。此时动态平衡的标准平衡常数表达式为:
 =
= 
对于一般的化学反应 AnBm(s=nA(aq)+ mB(aq), 溶度积  =C(A)^n×C(B)^m
=C(A)^n×C(B)^m
溶度积常数等于沉淀溶解平衡时,离子浓度幂的乘积,每种离子浓度的幂等于化学计量式的计量数。1
溶解度和溶度积的互相换算1、已知溶度积 , 计算溶解度S
例、已知 在298.15K时的溶度积为
在298.15K时的溶度积为 ,求
,求 在298.15K时的溶解度。
在298.15K时的溶解度。
解:设BaSO4的溶解度(S)为x mol·L
因 为难溶强电解质,且钡离子,硫酸根离子基本上不水解,所以在
为难溶强电解质,且钡离子,硫酸根离子基本上不水解,所以在 饱和溶液中:
饱和溶液中:
 = C(
= C( )
)
x·x =
S = x = ,换算单位S = M
,换算单位S = M 
 g/L
g/L
(1)AB型难溶强电解质 计算结果表明:对于基本上不水解的AB型难溶强电解质,其溶解度(S )在数值上等于其溶度积的平方根与摩尔质量之积。即:
S =M

(2) 型难溶强电解质 同时可推导出
型难溶强电解质 同时可推导出 (或
(或 )型难溶电解质(如
)型难溶电解质(如 等)其溶度积和溶解度的关系为:
等)其溶度积和溶解度的关系为:
c(A)c(B)= ( )(c)
)(c)
S×(2S)=  =
=
所以:S =
 M
M
也近似地适用于微弱水解的AB型、A2B(或AB2)型难溶强电解质。如 、AgCl、AgBr、AgI等,但不适用于易水解的难溶电解质(如ZnS)和难溶弱电解质及在溶液中易以离子对形式存在的难溶电解质。
、AgCl、AgBr、AgI等,但不适用于易水解的难溶电解质(如ZnS)和难溶弱电解质及在溶液中易以离子对形式存在的难溶电解质。
2、已知溶解度S , 计算溶度积 (S → )
与 上面所述是可逆过程, 只要列出与S 的关系式, 即能求解。12
溶解度与溶度积的异同1.两者都可以用来表示难溶电解质的溶解性大小。
2.溶度积是难溶解的固相与溶液中相应离子达到平衡时的离子浓度的乘积,只与温度有关。
溶解度不仅与温度有关,还与系统的组成,PH的改变,配合物的生成等因素有关。
3.
| 类型 | 化学式 | 溶度积(mol/L) | 溶解度(g/L) |
| AB | AgCl | 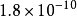 | 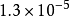 |
| AB | AgBr | 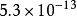 | 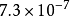 |
 |  | 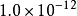 | 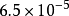 |
可以看出,氯化银的溶度积大于溴化银,同时溶解度也大;但是,氯化银的溶度积大于 ,溶解度反而小。这是因为两者的化学式不同,换算关系也不同导致的。因此,只有同一个类型的难溶电解质才可以通过溶度积比较溶解度。3
,溶解度反而小。这是因为两者的化学式不同,换算关系也不同导致的。因此,只有同一个类型的难溶电解质才可以通过溶度积比较溶解度。3
离子积IP(ion product):任一条件下离子浓度幂的乘积。Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是IP的一个特例。
数值分析1. IP=Ksp 表示溶液是饱和的。这时溶液中的沉淀与溶解达到动态平衡,既无沉淀析出又无沉淀溶解。
2. IPKsp 表示溶液为过饱和。溶液会有沉淀析出3
常用溶度积常数难溶化合物的溶度积常数 | |||
Solubility Products of Undissolved Compounds | |||
序号 | 分 子 式(Molecular formula) | Ksp | pKsp |
(No.) | (-lgKsp) | ||
1 | Ag3AsO4 | 1.0×10 | 22 |
2 | AgBr | 5.0×10 | 12.3 |
3 | AgBrO3 | 5.50×10 | 4.26 |
4 | AgCl | 1.8×10 | 9.75 |
5 | AgCN | 1.2×10 | 15.92 |
6 | Ag2CO3 | 8.1×10 | 11.09 |
7 | Ag2C2O4 | 3.5×10 | 10.46 |
8 | Ag2Cr2O4 | 1.2×10 | 11.92 |
9 | Ag2Cr2O7 | 2.0×10 | 6.7 |
10 | AgI | 8.3×10 | 16.08 |
11 | AgIO3 | 3.1×10 | 7.51 |
12 | AgOH | 2.0×10 | 7.71 |
13 | Ag2MoO4 | 2.8×10 | 11.55 |
14 | Ag3PO4 | 1.4×10 | 15.84 |
15 | Ag2S | 6.3×10 | 49.2 |
16 | AgSCN | 1.0×10 | 12 |
17 | Ag2SO3 | 1.5×10 | 13.82 |
18 | Ag2SO4 | 1.4×10 | 4.84 |
19 | Ag2Se | 2.0×10 | 63.7 |
20 | Ag2SeO3 | 1.0×10 | 15 |
21 | Ag2SeO4 | 5.7×10 | 7.25 |
22 | AgVO3 | 5.0×10 | 6.3 |
23 | Ag2WO4 | 5.5×10 | 11.26 |
24 | Al(OH)3 | 4.57×10 | 32.34 |
25 | AlPO4 | 6.3×10 | 18.24 |
26 | Al2S3 | 2.0×10 | 6.7 |
27 | Au(OH)3 | 5.5×10 | 45.26 |
28 | AuCl3 | 3.2×10 | 24.5 |
29 | AuI3 | 1.0×10 | 46 |
30 | Ba3(AsO4)2 | 8.0×10 | 50.1 |
31 | BaCO3 | 5.1×10 | 8.29 |
32 | BaC2O4 | 1.6×10 | 6.79 |
33 | BaCrO4 | 1.2×10 | 9.93 |
34 | Ba3(PO4)2 | 3.4×10 | 22.44 |
35 | BaSO4 | 1.1×10 | 9.96 |
36 | BaS2O3 | 1.6×10 | 4.79 |
37 | BaSeO3 | 2.7×10 | 6.57 |
38 | BaSeO4 | 3.5×10 | 7.46 |
39 | Be(OH)2 | 1.6×10 | 21.8 |
40 | BiAsO4 | 4.4×10 | 9.36 |
41 | Bi2(C2O4)3 | 3.98×10 | 35.4 |
42 | Bi(OH)3 | 4.0×10 | 30.4 |
43 | BiPO4 | 1.26×10 | 22.9 |
44 | CaCO3 | 2.8×10 | 8.54 |
45 | CaC2O4·H2O | 4.0×10 | 8.4 |
46 | CaF2 | 2.7×10 | 10.57 |
47 | CaMoO4 | 4.17×10 | 7.38 |
48 | Ca(OH)2 | 5.5×10 | 5.26 |
49 | Ca3(PO4)2 | 2.0×10 | 28.7 |
50 | CaSO4 | 9.12×10-6 | 5.04 |
51 | CaSiO3 | 2.5×10 | 7.6 |
52 | CaWO4 | 8.7×10 | 8.06 |
53 | CdCO3 | 5.2×10 | 11.28 |
54 | CdC2O4·3H2O | 9.1×10 | 7.04 |
55 | Cd3(PO4)2 | 2.5×10 | 32.6 |
56 | CdS | 8.0×10 | 26.1 |
57 | CdSe | 6.31×10 | 35.2 |
58 | CdSeO3 | 1.3×10 | 8.89 |
59 | CeF3 | 8.0×10 | 15.1 |
60 | CePO4 | 1.0×10 | 23 |
61 | Co3(AsO4)2 | 7.6×10 | 28.12 |
62 | CoCO3 | 1.4×10 | 12.84 |
63 | CoC2O4 | 6.3×10 | 7.2 |
64 | Co(OH)2(蓝) | 6.31×10 | 14.2 |
Co(OH)2 (粉红,新沉淀) | 1.58×10 | 14.8 | |
Co(OH)2 (粉红,陈化) | 2.00×10 | 15.7 | |
65 | CoHPO4 | 2.0×10 | 6.7 |
66 | Co3(PO4)3 | 2.0×10 | 34.7 |
67 | CrAsO4 | 7.7×10 | 20.11 |
68 | Cr(OH)3 | 6.3×10 | 30.2 |
69 | CrPO4·4H2O(绿) | 2.4×10 | 22.62 |
CrPO4·4H2O(紫) | 1.0×10 | 17 | |
70 | CuBr | 5.3×10 | 8.28 |
71 | CuCl | 1.2×10 | 5.92 |
72 | CuCN | 3.2×10 | 19.49 |
73 | CuCO3 | 2.34×10 | 9.63 |
74 | CuI | 1.1×10 | 11.96 |
75 | Cu(OH)2 | 4.8×10 | 19.32 |
76 | Cu3(PO4)2 | 1.3×10 | 36.9 |
77 | Cu2S | 2.5×10 | 47.6 |
78 | Cu2Se | 1.58×10 | 60.8 |
79 | CuS | 6.3×10 | 35.2 |
80 | CuSe | 7.94×10 | 48.1 |
81 | Dy(OH)3 | 1.4×10 | 21.85 |
82 | Er(OH)3 | 4.1×10 | 23.39 |
83 | Eu(OH)3 | 8.9×10 | 23.05 |
84 | FeAsO4 | 5.7×10 | 20.24 |
85 | FeCO3 | 3.2×10 | 10.5 |
86 | Fe(OH)2 | 8.0×10 | 15.1 |
87 | Fe(OH)3 | 4.0×10 | 37.4 |
88 | FePO4 | 1.3×10 | 21.89 |
89 | FeS | 6.3×10 | 17.2 |
90 | Ga(OH)3 | 7.0×10 | 35.15 |
91 | GaPO4 | 1.0×10 | 21 |
92 | Gd(OH)3 | 1.8×10 | 22.74 |
93 | Hf(OH)4 | 4.0×10 | 25.4 |
94 | Hg2Br2 | 5.6×10 | 22.24 |
95 | Hg2Cl2 | 1.3×10 | 17.88 |
96 | HgC2O4 | 1.0×10 | 7 |
97 | Hg2CO3 | 8.9×10 | 16.05 |
98 | Hg2(CN)2 | 5.0×10 | 39.3 |
99 | Hg2CrO4 | 2.0×10 | 8.7 |
100 | Hg2I2 | 4.5×10 | 28.35 |
101 | HgI2 | 2.82×10 | 28.55 |
102 | Hg2(IO3)2 | 2.0×10 | 13.71 |
103 | Hg2(OH)2 | 2.0×10 | 23.7 |
104 | HgSe | 1.0×10 | 59 |
105 | HgS(红) | 4.0×10 | 52.4 |
106 | HgS(黑) | 1.6×10 | 51.8 |
107 | Hg2WO4 | 1.1×10 | 16.96 |
108 | Ho(OH)3 | 5.0×10 | 22.3 |
109 | In(OH)3 | 1.3×10 | 36.9 |
110 | InPO4 | 2.3×10 | 21.63 |
111 | In2S3 | 5.7×10 | 73.24 |
112 | La2(CO3)3 | 3.98×10 | 33.4 |
113 | LaPO4 | 3.98×10 | 22.43 |
114 | Lu(OH)3 | 1.9×10 | 23.72 |
115 | Mg3(AsO4)2 | 2.1×10 | 19.68 |
116 | MgCO3 | 3.5×10 | 7.46 |
117 | MgCO3·3H2O | 2.14×10 | 4.67 |
118 | Mg(OH)2 | 1.8×10 | 10.74 |
119 | Mg3(PO4)2·8H2O | 6.31×10 | 25.2 |
120 | Mn3(AsO4)2 | 1.9×10 | 28.72 |
121 | MnCO3 | 1.8×10 | 10.74 |
122 | Mn(IO3)2 | 4.37×10 | 6.36 |
123 | Mn(OH)4 | 1.9×10 | 12.72 |
124 | MnS(粉红) | 2.5×10 | 9.6 |
125 | MnS(绿) | 2.5×10 | 12.6 |
126 | Ni3(AsO4)2 | 3.1×10 | 25.51 |
127 | NiCO3 | 6.6×10 | 8.18 |
128 | NiC2O4 | 4.0×10 | 9.4 |
129 | Ni(OH)2(新) | 2.0×10 | 14.7 |
130 | Ni3(PO4)2 | 5.0×10 | 30.3 |
131 | α-NiS | 3.2×10 | 18.5 |
132 | β-NiS | 1.0×10 | 24 |
133 | γ-NiS | 2.0×10 | 25.7 |
134 | Pb3(AsO4)2 | 4.0×10 | 35.39 |
135 | PbBr2 | 4.0×10 | 4.41 |
136 | PbCl2 | 1.6×10 | 4.79 |
137 | PbCO3 | 7.4×10 | 13.13 |
138 | PbCrO4 | 2.8×10 | 12.55 |
139 | PbF2 | 2.7×10 | 7.57 |
140 | PbMoO4 | 1.0×10 | 13 |
141 | Pb(OH)2 | 1.2×10 | 14.93 |
142 | Pb(OH)4 | 3.2×10 | 65.49 |
143 | Pb3(PO4)3 | 8.0×10 | 42.1 |
144 | PbS | 1.0×10 | 28 |
145 | PbSO4 | 1.6×10 | 7.79 |
146 | PbSe | 7.94×10 | 42.1 |
147 | PbSeO4 | 1.4×10 | 6.84 |
148 | Pd(OH)2 | 1.0×10 | 31 |
149 | Pd(OH)4 | 6.3×10 | 70.2 |
150 | PdS | 2.03×10 | 57.69 |
151 | Pm(OH)3 | 1.0×10 | 21 |
152 | Pr(OH)3 | 6.8×10 | 21.17 |
153 | Pt(OH)2 | 1.0×10 | 35 |
154 | Pu(OH)3 | 2.0×10 | 19.7 |
155 | Pu(OH)4 | 1.0×10 | 55 |
156 | RaSO4 | 4.2×10 | 10.37 |
157 | Rh(OH)3 | 1.0×10 | 23 |
158 | Ru(OH)3 | 1.0×10 | 36 |
159 | Sb2S3 | 1.5×10 | 92.8 |
160 | ScF3 | 4.2×10 | 17.37 |
161 | Sc(OH)3 | 8.0×10 | 30.1 |
162 | Sm(OH)3 | 8.2×10 | 22.08 |
163 | Sn(OH)2 | 1.4×10 | 27.85 |
164 | Sn(OH)4 | 1.0×10 | 56 |
165 | SnO2 | 3.98×10 | 64.4 |
166 | SnS | 1.0×10 | 25 |
167 | SnSe | 3.98×10 | 38.4 |
168 | Sr3(AsO4)2 | 8.1×10 | 18.09 |
169 | SrCO3 | 1.1×10 | 9.96 |
170 | SrC2O4·H2O | 1.6×10 | 6.8 |
171 | SrF2 | 2.5×10 | 8.61 |
172 | Sr3(PO4)2 | 4.0×10 | 27.39 |
173 | SrSO4 | 3.2×10 | 6.49 |
174 | SrWO4 | 1.7×10 | 9.77 |
175 | Tb(OH)3 | 2.0×10 | 21.7 |
176 | Te(OH)4 | 3.0×10 | 53.52 |
177 | Th(C2O4)2 | 1.0×10 | 22 |
178 | Th(IO3)4 | 2.5×10 | 14.6 |
179 | Th(OH)4 | 4.0×10 | 44.4 |
180 | Ti(OH)3 | 1.0×10 | 40 |
181 | TlBr | 3.4×10 | 5.47 |
182 | TlCl | 1.7×10 | 3.76 |
183 | Tl2CrO4 | 9.77×10 | 12.01 |
184 | TlI | 6.5×10 | 7.19 |
185 | TlN3 | 2.2×10 | 3.66 |
186 | Tl2S | 5.0×10 | 20.3 |
187 | TlSeO3 | 2.0×10 | 38.7 |
188 | UO2(OH)2 | 1.1×10 | 21.95 |
189 | VO(OH)2 | 5.9×10 | 22.13 |
190 | Y(OH)3 | 8.0×10 | 22.1 |
191 | Yb(OH)3 | 3.0×10 | 23.52 |
192 | Zn3(AsO4)2 | 1.3×10 | 27.89 |
193 | ZnCO3 | 1.4×10 | 10.84 |
194 | Zn(OH)2 | 2.09×10 | 15.68 |
195 | Zn3(PO4)2 | 9.0×10 | 32.04 |
196 | α-ZnS | 1.6×10 | 23.8 |
197 | β-ZnS | 2.5×10 | 21.6 |
198 | ZrO(OH)2 | 6.3×10 | 48.2 |
①~③:形态均为无定形。 |
难溶电解质的溶度积常数
名称 | 化学式 | Ksp | 名称 | 化学式 | Ksp |
氯化银 | AgCl | 1.56×10^-10 | 氢氧化铁 | Fe(OH)3 | 1.1×10^-36 |
溴化银 | AgBr | 7.7×10^-13 | 硫化铁 | FeS | 3.7×10^-19 |
碘化银 | AgI | 1.5×10^-16 | 氯化亚汞 | Hg2Cl2 | 2×10^-18 |
铬酸银 | Ag2CrO4 | 9.0×10^-12 | 溴化亚汞 | Hg2Br2 | 1.3×10^-21 |
碳酸钡 | BaCO3 | 8.1×10^-9 | 碘化亚汞 | Hg2I2 | 1.2×10^-28 |
铬酸钡 | BaCrO4 | 1.6×10^-10 | 硫化汞 | HgS | 4×10^-53~2×10^-49 |
硫酸钡 | BaSO4 | 1.08×10^-10 | 碳酸锂 | Li2CO3 | 1.7×10^-3 |
碳酸钙 | CaCO3 | 8.7×10^-9 | 碳酸镁 | MgCO3 | 2.6×10^-5 |
草酸钙 | CaC2O4 | 2.57×10^-9 | 氢氧化镁 | Mg(OH)2 | 1.2×10^-11 |
氟化钙 | CaF2 | 3.95×10^-11 | 氢氧化锰 | Mn(OH)2 | 4×10^-14 |
硫酸钙 | CaSO4 | 1.96×10^-4 | 硫化锰 | MnS | 1.4×10^-15 |
硫化镉 | CdS | 3.6×10^-29 | 碳酸铅 | PbCO3 | 3.3×10^-14 |
硫化铜 | CuS | 8.5×10^-45 | 铬酸铅 | PbCrO4 | 1.77×10^-14 |
硫化亚铜 |
|


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

