非对映异构体以赤式(erythro)和苏式(threo)标记。赤式异构体是两个相同取代基在费歇尔投影式中处于同侧的异构体,苏式则相反。
定义非对映异构体以赤式(erythro)和苏式(threo)标记。赤式异构体是两个相同取代基在费歇尔投影式中处于同侧的异构体,苏式则相反。1
举例与苏阿糖构型相似者为苏式构型;与赤藓糖构型相似者为赤式构型。例:1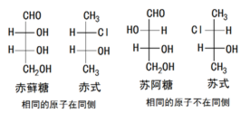
简单的说也就是两个异构体之间的关系就如同一个物体的立体结构在照镜子,这个立体结构和它在镜子中的像互为对映异构体。
1、两个互为镜像而不能重合的立体异构体,称为对映异构体,简称对映体。
2、对映体是指具有相同分子式的化合物中,由于原子在空间配置不同而引起的同分异构现象。
3、互为旋光异构体的两种化合物,由于其中一个不对称碳原子的取代基在空间上取向不同而互成物体与镜像的关系,并且两者在空间上不能重叠,它们被称为对映体。
对映体具有相同的物理性质(如熔点,沸点,溶解度,折射率,酸性,密度等),热力学性质(如自由能,焓、熵等)和化学性质。除非在手性环境(如手性试剂,手性溶剂)中才表现出差异。
对映体对偏振光的作用不同,它们的比旋光度数值相同,但方向相反。对映体的生物活性不相同,化学反应中表现出等速率。等量的左旋体与右旋体的混合物构成外消旋体。从对映体中分离出单纯一个光学异构体的方法称拆解。最普通的拆解方法是将消旋体与光学活性相反的离子(称拆解剂)作用生成非对映体。1
非对映异构体两个结构相同的分子,由于具有构型不同的不对称原子,彼此不呈实物与镜像的关系。
非对映异构体的旋光性不同,熔点、沸点、溶解度、密度、折射率等物理性质也很不同。其化学性质虽然相似,但也不完全相同。
非对映异构体是由已含有一个手性中心的分子产生第二个手性中心时的必然产物。与对映体的生成不同,由于第一个手性中心的影响,所得到的两个非对映异构体的数量并不相同。这就是不对称合成的基础。1
几何异构在有双键或小环结构(如环丙烷)的分子中,由于分子中双键或环的原子间的键的自由旋转受阻碍,存在不同的空间排列方式而产生的立体异构现象,又称顺反异构。1
旋光异构又称为手性异构,任何一个不能和它的镜像完全重叠的分子就叫做手性分子,它的一个物理性质就是能使偏振光的方向发生偏转,具有旋光活性。
构造相同的分子,如使其一平面偏振光向右偏转,另一侧向左。则两种互为光学异构体。(所谓光学异构体指分子结构完全相同,物理化学性质相近,但旋光性不同的物质)。1
构象异构构造式相同的化合物由于单键的旋转,使连接在碳上的原子或原子团在空间的排布位置随之发生变化产生的立体异构现象。
能发生立体异构现象的化合物称作立体异构体,包括几何异构体、旋光异构体和构象异构体。几何异构体和旋光异构体能分离开来,构象异构体可以通过单键旋转而互变,通常无法分离,但当围绕单键旋转障碍很大时,这类异构体也是可以分离的。1
立体化学中赤式与苏式的描述Fischer式、锯架式、飞楔式及Newman 投影式1891年Fischer在他研究葡萄糖等单糖的立体结构的过程中,首创了现在普遍采用的“Fischer ” 投影结构式。Fischer投影式是将不对称碳原子上竖向(上下) 所连接的两个原子或基团朝向纸平面内,横向(左右) 连接他两个原子或基团朝向纸平面外所得到的投影式。
例如己d-乳酸Fischer投影式在表示含有一个不对称碳原子的化合物的立体结构时是很适宜的。但这种投影式只能在纸面上转动n x 180 ( n = 1 , 2 , 3 )而不能使之翻转。Fischer投影式描述的立体结构全是重迭式构象,即各基团全部是相互“ 重迭” 的,达到了分子内基团间最拥挤的程度,然而,分子的真正形象却很少是这个样子,而是更倾向于各个基团相互错开一个60角成为“ 交叉” 式的稳定构象式,这种构象势垒最低。为了用不同方式描述分子的立体异构,人们除了采用Fischer式外还采用了锯架式、飞楔式和Newman 投影式。如图4、5所示:
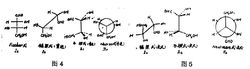
以上的几种结构式为同一个化合物d一苏阿糖的分子立体结构的几种表示法。从这四种形式看,以飞楔式较接近于所表达的分子的立体形象的真实状态,而Newman投影式却最能确凿地表示出两个直接相连的碳原子上的各个基团在空间所处的向位和关系。
Newman 投影式是表示相邻两个原子连接的基团之间空间关系的。所使用的表示方式如上图中IVa,其中的实线表示原子或基团连接在前面的碳原子上,不完全的线表示原子或基团连接在后面的碳原子上。锯架式能转变成纽曼投影式IVa 。因为连接两个碳原子的单键可以自由旋转,所以IVa只是这个立体异构体的多种表示方式之一。但在讨论具有两个相同手性碳原子的对映异构体的稳定性时,Newman 投影式的优越性便能明显地表现出来。例如在图6 内消旋体的三种交叉构象中:
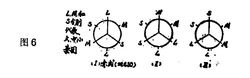
(l)比(II) 和(III) 都稳定。
对映体之一的交叉构象如图7一般以(IV) 最稳定:

内消旋(I) 和旋光性的(IV),两种最稳定的构象的不同在于(I)中2个S一M 邻位交叉的相互作用,而旋光性的(IV) 中则有M 一M 和S 一S邻位交叉的相互作用。根据一般原理,立体的相互作用是( M 一M ) + ( S 一S )大于 ( M 一S )。故内消旋一般比相应的旋光性异构体稳定(只考虑纯立体因素影响)。内消旋(I)相当于赤型,(IV) 则相当于苏型。赤型往往比苏型稳定。
从横式飞楔式判断赤式和苏式的一般方法(1)在全重迭式的构象中,若两个相邻的不对称碳上连有两组相同的原子或原子团时相同基团完全重迭者(即按实线对实线、楔形线对楔形线、虚线对虚线的重迭方式) 为赤式;反之两个手性碳上相同基团不能全重迭者为苏式。
(2)若两个相邻的不对称碳原子上仅连有一组相同的原子或原子团时,判断其赤式和苏式,习惯的方法是先令其分子中的官能即(即参与反应的原子或原子团) 彼此重叠,其余两组原子或原子团分别按相同一相异原子(或原子团) 重迭者为赤式,相异一相异原子( 或原子团) 重迭者为苏式。
(3)这里必须指出,用习惯的投影式的写法,无论对开链的或环状的(多指平面环)都没有考虑它们最稳定的构象式。对映体的构型只是为了识别分子空间排布的特点。直链状化合物中,根根动态立体化学原理,分子会产生种种构象(如最典型的九种构象:反交叉式,部分重迭式,顺交叉式,全重迭式等等),在几种典型构象中反交叉式构象能量最低,最稳定,这类产物生成最多。赤式便是反交叉式,也是交叉式中最稳定者,而苏式属顺交叉式,故不及赤式稳定。但是苏式又是顺交叉式中较稳定者。2
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

