分子由于构象不同而对分子的化学反应性质所产生的不同影响统称为构象效应。构象对反应活性的影响要考虑参与反应的基团构象的必要条件和不参与反应的基团构象的必要条件。可用构象效应解释不对称合成的立体化学,更重要的是可用它推断不对称合成产物的构型。1
简介化合物的结构、反应机制和合成三者的关系极其密切,相互依存。D.H.R.Barton在研究甾族化合物的反应时,在Hassel构象概念基础上提出了构象分析的基本原理,指出了反应性与构象之间的联系。这是有机结构理论的一个突破性进展,也是动态立体化学的开始。反应机制与构象分析相结合,使许多反应的立体化学,即反应方向如区域选择性和立体选择性等可以预测,进而大大提高了有机合成设计的正确率。
环己烷衍生物分子的椅式构象中,取代基往往尽可能多地处于平伏键,以避免位于直键位所带来的1,3-二直键相互作用。而E.J.Corey发现,构象刚性的环己烷类化合物分子,其环上碳原子受进攻时,成键位于直键位的产物反而占优势。
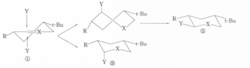
例如,化合物①构象刚性,进攻试剂Y可从双键所在平面的上方或下方垂直接近底物,从平面上方进攻需经历扭船式中间体,而从平面下方无需经历这样的中间体,所以反应历程中的过渡态或中间体的构象的能量差别是导致直键产物占优势的直接原因。这种效应在有机化学文献中名称各异,有的称为构象效应,有的称为几何制约,有的称为构象最小改变原理。2
举例分析分子由于构象不同而对分子的化学反应性质所产生的不同影响可统称为构象效应。下面举例加以说明。
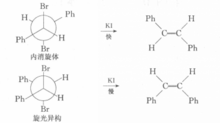
例一2,3一二溴丁烷非对映体,在反应上表现出不同的反应速度,如在碘化钾一丙酮中的脱溴反应,内消旋体的反应速度比旋光异构体快1.8倍。该反应按E2历程进行,E2反应对分子中被消除的两个基团(此处为Br和Br)的立体化学要求是反式共平面。2,3-二溴丁烷内消旋体的优势构象为对位交叉式,恰好符合E2反应的立体化学要求,而且两个较大的基团(一CH3)距离远,过渡态稳定。
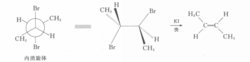
在2,3-二溴丁烷旋光异构体的构象中,如能满足两个离去基团处于反式共平面的位置,则两个较大基团(一CH3)为邻位交叉式,距离近,过渡态不稳定,故旋光异构体脱溴反应速度较慢。
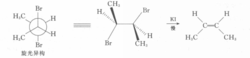
而甲基被苯基替代后的脱溴反应速度,内消旋体比旋光异构体快100倍。这是因为苯基的体积较大,两个大体积的苯基处于同侧时过渡态更不稳定,需要更大的活化能。
1,4-叔丁基环己醇,其反式乙酰化速度比顺式醇的大3.7倍。
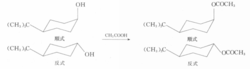
这是因为乙酰化反应速度取决于活化能的大小。活化能小的反应速度快,反式的活化能低,只有0.17kJ·mol-1。同时,由于反式醇处于平伏键上,它比顺式醇稳定,它的乙酰化中间体过渡态的张力要比直立键的同样中间过渡态小。2
构象效应与化学活性最早指出构象与化学活性之间关系的是巴顿(Barton)。研究分子的构象不仅要了解分子的形状及稳定构象,还要研究构象对反应活性的影响,尤其后者的研究是相当广泛的。其中在环己烷体系中反应活性的构象效应曾被深入地研究过,对于发生反应的官能团,处于直立键上或是平伏键上其反应速度有明显的差别。
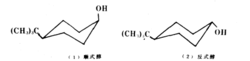
顺式醇羟基在直立键上,反式醇羟基在平伏键上,反式醇显然比顺式醇稳定。酰化反应的速度取决于活化自由能的大小,当乙酰基对羟基亲电进攻时,由于反式醇的羟基处于平伏键上,它比顺式醇稳定.因而反式醇乙酰化中间过渡态的张力要比顺式醇的中间过渡态小些,反式的过渡态能量比顺式的过渡态能量不止低2.90kJ/mol,活化能较小,由此可知反式醇乙酰化反应速度比顺式醇快。如下图所示:
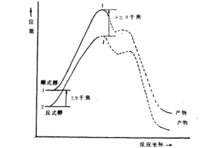
顺式醇之所以比反式醇氧化的速度快,也是由于反应的活化自由能不同的缘故。从中间体的结构来看,先是铬酸与醇形成酯在C-H断裂的同时消去一分子四价铬化合物,由于直立式的相互排斥,所以顺式酯的分解速度较反式酯的分解要快。它们在反应过程中的过渡态能量相差不到2.90k J/mol,速度相差约3倍。3
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

