在反应过程中,若发生反应的部位位于反应分子平面两侧的称为反面反应,更多的用异面来表示,用a表示。一般同面和异面的概念常用来描述轨道反应。
在判断周环反应时,有重要作用。
定义在反应过程中,若发生反应的部位位于反应分子平面两侧的称为反面反应,更多的用异面来表示,用a表示。一般同面和异面的概念常用来描述轨道反应。1
背景知识价键理论未成对自旋相反电子偶合配对,成键原子的电子云相互交盖重叠形成共价键,成键电子云定域于两原子之间;共价键具有饱和性。如一个原子的未成对电子已配对成键,就不能再与其它原子的未成对原子配对成键;共价键具有方向性。电子云重叠愈多,形成的键愈强,因此要尽可能在电子云密度最大的地方重叠;能量相近的原子轨道可以进行杂化,组成能量相等的杂化轨道,这样可使成键能力更强,体系能量降低,成键后达到最稳定的分子状态。1
分子轨道理论分子轨道由原子轨道通过线性组合而成,形成的分子轨道数与参与组成的原子轨道数相等,分子轨道有成键分子轨道、非键分子轨道和反键分子轨道。原子轨道组成分子轨道时,必具备能量相近、电子云最大重叠及对称性相同三个条件。成键电子云离域于整个分子。
分子轨道的能量随节面数的增多而增多。1
有效成键三原则分子轨道理论认为化学键有效生成必须满足三个基本原则:
1)能量近似原则
两个能量相差很大的原子轨道组成分子轨道时,成键轨道的能量之和与原子轨道的能量近,即在成键过程中能量降低很少,故不能形成稳定的分子轨道.
2)电子云最大重叠原则
两个原子轨道的电子云重叠程度越大形成的化学键越牢固。
3)对称性相同原则
只有对称性相同的原子轨道才能组成分子轨道。1
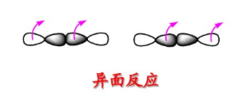
反面反应的类型(1)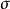 键的反面反应2
键的反面反应2
反应在中间一瓣或者另一瓣间进行是反面反应。异面断裂后,此时键连的两个原子轨道一个原子以正瓣成键并保持构型,另一个原子以负瓣成键并翻转构型。
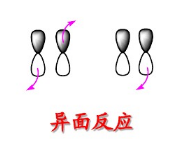
(2)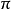 键的反面反应2
键的反面反应2
反应在两侧发生的是反面反应。
(3)单一非键空p轨道的反面反应反应在两侧发生的是反面反应。2

重要的应用-周环反应判断原则现将判断周环反应的选择规则统一为一个规则: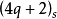 或
或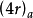 规则(q、r为整数,包括0。s:表示同面反应,a:表示异面反应)。
规则(q、r为整数,包括0。s:表示同面反应,a:表示异面反应)。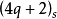 即参加周环反应的电子总数为4q十2(或电子对数为奇数)时,同面反应为热允许反应。
即参加周环反应的电子总数为4q十2(或电子对数为奇数)时,同面反应为热允许反应。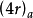 即参加周环反应的电子总数为4r(或电子对数为偶数)时,异面反应为热允许反应。
即参加周环反应的电子总数为4r(或电子对数为偶数)时,异面反应为热允许反应。
Dewar-Zimmerman规则:

Woodward-Hoffmann规则:

将Dewar-Zimmerman和Woodward-Hoffmann规则统一为一个规则是因为这两个规则的实质是一致的,都是以分子轨道的基本概念为基础,从不同的角度分析周环反应过程的能量变化关系,以期找出能量最低的过渡状态,判断反应进行的方式和立体化学选择规则。
一个周环反应是热允许反应还是热禁阻反应从本质上讲当然是轨道对称守恒的问题,也可以认为主要决定于两个因素:(l)参加反应的电子总数(或电子对数);(2)反应进行的方式,是同面反应还是异面反应。我们发现,每增加一对电子允许反应就成了禁阻反应,若换一种反应方式即同面反应换成异面反应,或异面反应换成同面反应,则反应仍为允许反应。
Dewar一Zimmerman规则的实质是讨论周环反应形成的环状过渡态的芳香性(稳定性),若与相应的开链化合物相比是稳定的,则为允许反应,否则为禁阻反应。根据芳香过渡态理论,Hukel型过渡态中各原子轨道间的位相符号发生零次变化或偶数次变化,这里实际上进行的是同面反应。而Mobuis型过渡态中各原子轨道间的位相符号发生奇数次变化,发生的是异面反应,所以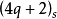 说的就是Huckel型过渡态的情况。
说的就是Huckel型过渡态的情况。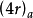 说的是Mobuis型过渡态的情况。 Woodward一Hoffmann规则从分析所有参与反应的分子轨道的对称性人手,判断周环反应进行的条件和方式,讨论的是Huckel体系,上表所述选择规则是建立在同面反应的基础上的,也就是说Woodward一Hoffmann规则即可用
说的是Mobuis型过渡态的情况。 Woodward一Hoffmann规则从分析所有参与反应的分子轨道的对称性人手,判断周环反应进行的条件和方式,讨论的是Huckel体系,上表所述选择规则是建立在同面反应的基础上的,也就是说Woodward一Hoffmann规则即可用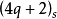 概括。
概括。
在电环化反应中,顺旋即为异面反应,对旋即为同面反应,在基态下4n体系顺旋,4n十2体系对旋为允许反应,与上述规则一致。
在环加成和迁移反应中,两组份的电子总数为(4q+2)时(或电子对总数为奇数时),同面一同面(s~s)反应或异面一异面(a~a)反应为热允许反应,若两组份电子总数为(4r)时(或电子对总数为偶数时),同面一异面(s~a)或异面一同面(a~s)反应为热允许反应。
综上所述,在周环反应中参与反应的电子总数为4n+2的同面反应或参与反应的电子总数为4n的异面反应为热允许反应,反之为热禁阻或光允许反应。3
本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

