氯化铯化学式为CsCl,分子量为168.36。在体心立方结构中,若各顶角位置是氯离子,各中心位置是铯离子,每个铯离子紧邻8个氯离子,同时每个氯离子紧邻8个铯离子,这就构成了氯化铯的晶体结构。
简介氯化铯(Cesium chloride),化学式为CsCl,分子量为168.36。是一种无机盐,无色立方晶体,密封阴凉干燥保存。熔点645℃,沸点1290℃,相对密度3.988;易溶于水、乙醇、甲醇,不溶于丙酮。在空气中吸湿潮解。氯化铯晶胞是素晶胞(可看成氯离子作简单立方堆积,铯离子填充立方空隙)。采取这种晶体结构的化合物包括CsCl,CsBr,CsI,TlCl,TlBr和NH4Cl等。高于445℃,氯化铯也具有配位数8的面心立方结构1。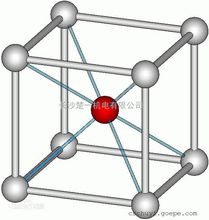
氯化铯合成方法1、将碳酸铯溶解于少量水中。在不断搅拌下慢慢加入相对密度为1.18的盐酸,加热反应:
Cs2CO3+ 2 HCl → 2 CsCl + 2 H2O + CO2
当pH=3时,煮沸半小时加入氢氧化铯使溶液pH值到中性。过滤,滤液蒸发浓缩至大量结晶析出,冷至室温,分离母液,洁净与100ºC烘干,即为成品。
2、用碳酸铯溶于盐酸,再浓缩其溶液以制取氯化铯。通常可得到纯度为99.5%的氯化铯,可直接使用。对不够纯净的氯化铯,可采用下列方法精制。
将15g的氯化铯,加热溶于100mL的水中。将化学计量24.2g氯化汞溶于25mL 4mol的盐酸中。趁热将此HgCl2/HCl溶液加到上述溶液中,搅拌混合,冷却,即可析出CsHgCl3结晶。吸滤,收集结晶,弃去母液。将结晶溶于120mL的热水中,冷却后再次有结晶析出。为此反复进行2~3次重结晶,碱金属可降至0.01%以下,最后将结晶溶于热水,通入H2S气体使溶液达到饱和,就有HgS沉淀析出,滤去HgS,收集滤液,蒸发至干,即可得纯净的氯化铯2。
氯化铯相关计算数据1、疏水参数计算参考值(XlogP):无
2、氢键供体数量:0
3、氢键受体数量:1
4、可旋转化学键数量:0
5、互变异构体数量:无
6、拓扑分子极性表面积:0
7、重原子数量:2
8、表面电荷:0
9、复杂度:2
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:2
本词条内容贡献者为:
黎明 - 副教授 - 西南大学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

