分子中含有两个或两个以上的可电离的H+的弱酸都是多元弱酸,多元弱酸在水溶液中的电离是分步进行的,每一步电离出一个H+,并且都有相对应的电离平衡及电离常数。
定义分子中含有两个或两个以上的可电离的H+的弱酸都是多元弱酸,多元弱酸是属于弱电解质。
根据酸中所含的可电离氢离子的数目,可以将酸分为一元酸(如HCl、CH3COOH)、二元酸(如H2SO4、H2CO3、H2S)、三元酸(如H3PO4)。其中,HCl为一元强酸,H2SO4虽然可以电离两个氢离子,但是是强酸,不属于多元弱酸,CH3COOH为一元弱酸。1
多元弱酸电离多元弱酸在水中的电离是分步进行的。以磷酸为例介绍
磷酸是三元弱酸,分三步解离。
第一步解离:H3PO4⇌ H+ + H2PO4- 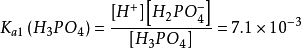
第二步解离:H2PO4-⇌ H++ HPO42- 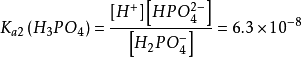
第三步解离:HPO42-⇌ H++ PO43- 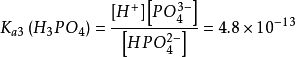
多元弱酸的电离常数都是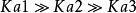 ,一般相差104~105。这是由于第二步解离需从带有一个负电荷的离子中再解离出一个H+,这当然比从中性分子解离出一个H+困难的多;此外,第一步解离出的H+将抑制第二步的解离。同理第三步比第二步更困难。因此,从数量上看,由第二三步解离出的H+与第一步解离相比是微不足道的,故在计算多元弱酸溶液中H+浓度时,只需要考虑第一步解离,可当做一元弱酸来处理。当对多元弱酸的相对强弱比较时,只需比较其一级解离常数即可。1
,一般相差104~105。这是由于第二步解离需从带有一个负电荷的离子中再解离出一个H+,这当然比从中性分子解离出一个H+困难的多;此外,第一步解离出的H+将抑制第二步的解离。同理第三步比第二步更困难。因此,从数量上看,由第二三步解离出的H+与第一步解离相比是微不足道的,故在计算多元弱酸溶液中H+浓度时,只需要考虑第一步解离,可当做一元弱酸来处理。当对多元弱酸的相对强弱比较时,只需比较其一级解离常数即可。1
多元弱酸的酸度计算多元弱酸在溶液中逐级离解,溶液是一个复杂的酸碱平衡体系。以二元弱酸(H2A)为例,设其浓度为c mol/L,解离常数分别为Ka1和Ka2。
1. 质子条件式 [H+] = [HA-] + [A2-] + [OH-] ,将有关平衡常数代入,并整理后得到计算[H+] 的精确式:
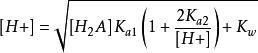
2. 计算[H+]的近似式和最简式
(1) 当cKa1≥ 20 Kw时,上式中的Kw项可忽略。
(2) 当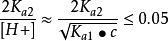 ,可将其略去,即第二步解离也可忽略,得
,可将其略去,即第二步解离也可忽略,得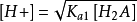 。而[H2A] ≈ c - [H+],代入整理得到二元弱酸中H+浓度的近似式:
。而[H2A] ≈ c - [H+],代入整理得到二元弱酸中H+浓度的近似式:
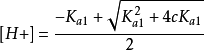
实际上是忽略了二级解离,将二元弱酸按照一元弱酸处理。一般多元弱酸,只要浓度不太小,各步解离常数差别不太小,均可按一元弱酸处理。
(3)当c/Ka1 ≥ 500时,而[H2A] ≈ c - [H+] ≈ c,得计算二元弱酸溶液中[H+]浓度的最简式: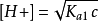 。2
。2
本词条内容贡献者为:
蒲富永 - 教授 - 西南大学
来源: 百度百科


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

