在现代医学中,心血管疾病(CVD)长期被归咎于高脂饮食、血压升高或遗传风险。但近年来的研究逐渐揭示,一个更隐秘的参与者——肠道菌群(gut microbiota)——正通过代谢物和信号分子深度介入动脉与心脏的健康。
2023 年发表在 Frontiers in Microbiology 的综述指出,肠道菌群与宿主之间存在一条复杂的“代谢通信轴”,决定着炎症、血脂、血管功能乃至心脏代谢的长期状态。
过去我们认为,饮食中的脂肪和胆固醇直接导致动脉硬化。但事实远不止如此。研究发现,肠道细菌能将食物中的胆碱、肉碱等营养物转化为三甲胺(TMA),经肝脏氧化生成三甲胺氧化物(TMAO)。这种分子可促使胆固醇在血管壁沉积、干扰胆汁酸代谢、增加血小板聚集,从而加速动脉粥样硬化。TMAO 水平越高,心肌梗死与中风风险越大——它几乎成为“微生物版的 LDL”。
与此同时,短链脂肪酸(SCFAs)、胆汁酸(BAs)与脂多糖(LPS)则扮演着另一面:有的保护心脏,有的煽动炎症。不同菌群平衡的微小变化,就可能让这些代谢信号完全翻转。
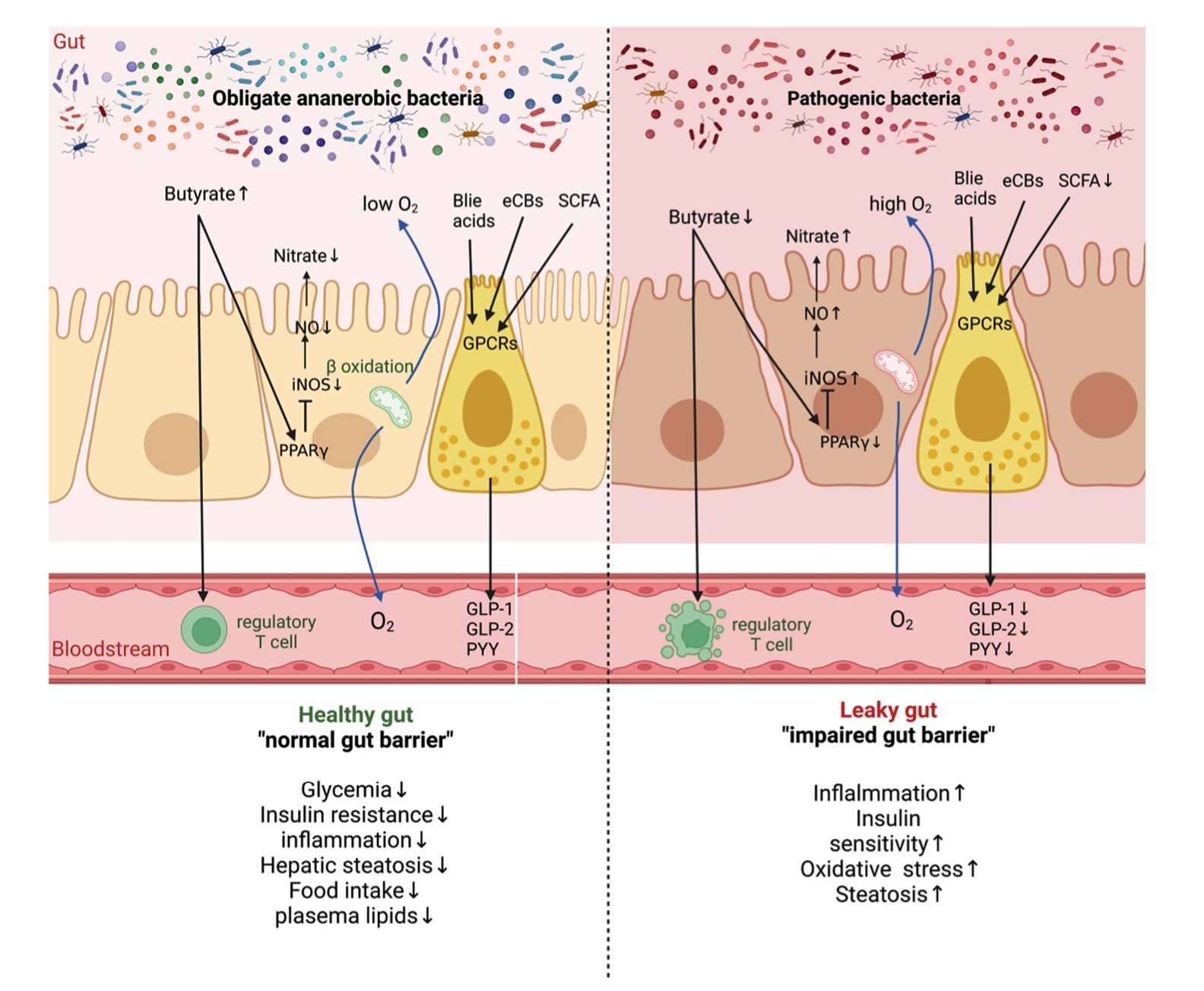
图1|肠道代谢物影响宿主代谢与炎症的机制
代谢物主要来源主要作用通路对心血管的影响
SCFAs(短链脂肪酸)纤维、抗性淀粉经发酵产生结合 GPR41/GPR43 受体,调节免疫与代谢抗炎、降压、改善胰岛素敏感性;
TMAO(三甲胺氧化物)蛋类、红肉、海鲜中的胆碱与肉碱促进胆固醇积聚与血小板活化增加动脉粥样硬化与血栓风险;
胆汁酸(BAs)肝脏合成,经菌群二次代谢激活 FXR 与 TGR5 受体,调控脂质代谢维持代谢稳态,部分次级胆汁酸具毒性;
脂多糖(LPS)革兰阴性菌外膜成分激活 TLR4 通路,引发炎症与内皮损伤促进低度慢性炎症与血管硬化。
研究者进一步指出,不同代谢物间存在交叉调控。例如,高脂饮食导致菌群多样性下降,产 SCFAs 的益生菌减少,肠屏障通透性上升,LPS 更易进入血液;而 SCFAs 本身又可抑制 TMA 生成酶 CutC,间接降低 TMAO 水平。这意味着,肠道代谢网络并非简单的“好菌 vs 坏菌”,而是一场化学博弈:谁主导,就决定心血管的命运。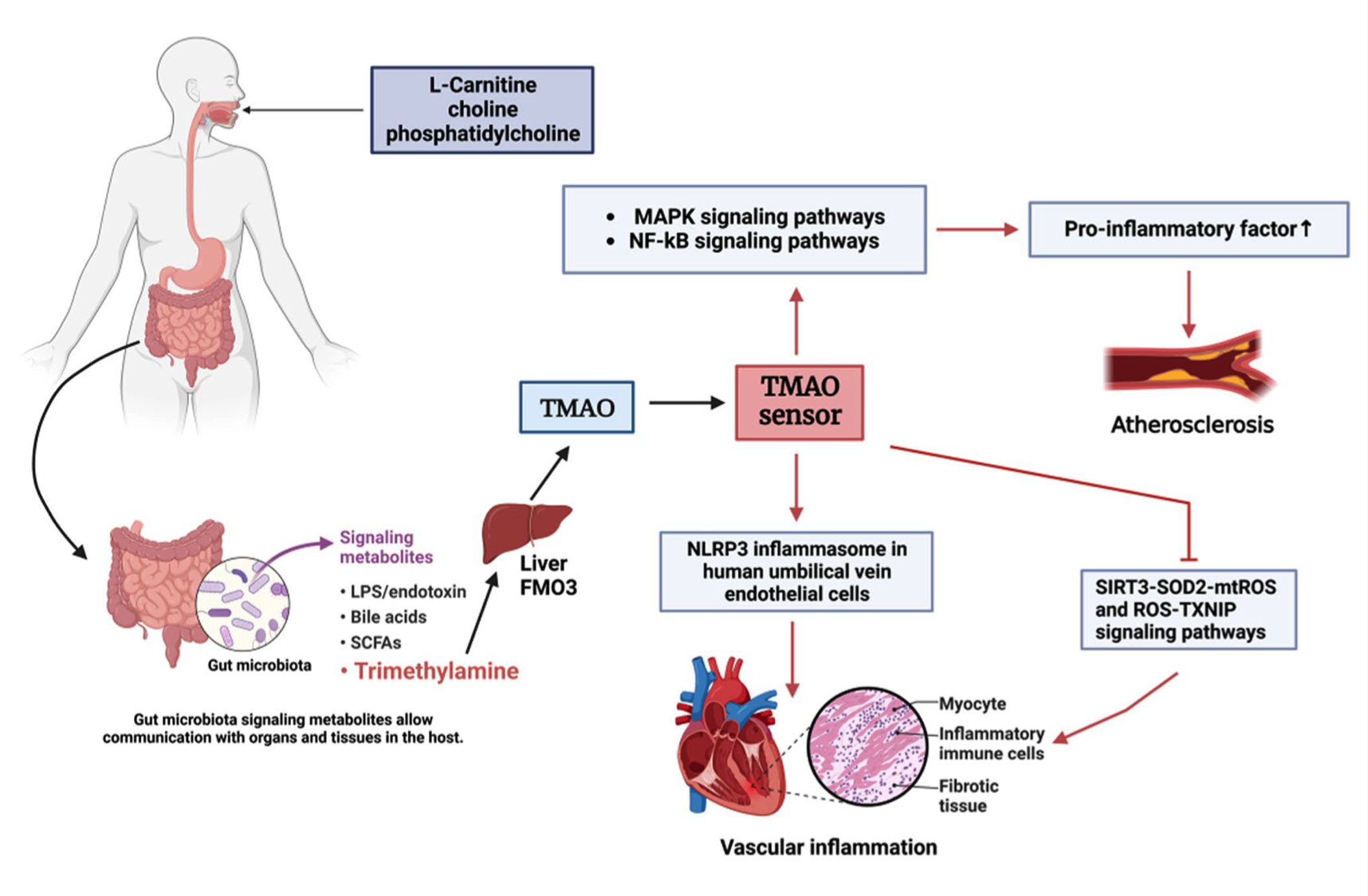
图2|TMAO 通路促进动脉粥样硬化形成的机制
理解这些机制,也让科学家看到了干预的希望。研究提出四类潜在策略:
1.益生菌与益生元:补充 Bifidobacterium、Akkermansia 等可产 SCFAs 的菌株,有助于降低炎症与血压。
2.饮食干预:高纤维、富多酚的饮食能促进有益菌增殖,抑制 TMA 生成。
3.靶向抑制剂:如 DMB(3,3-二甲基-1-丁醇)可直接抑制 CutC 酶,阻断 TMA/TMAO 通路。
4.粪菌移植(FMT):早期动物实验显示可重建健康菌群结构,改善血管功能。
未来的研究正从“观察”转向“控制”:通过 AI 与代谢组学,科学家希望精准识别个体菌群模式,从而制定个性化的饮食与微生物干预方案。正如论文所言,“控制肠道化学,等于重新编程心血管命运。”
参考文献
Liu X., Zhang Y., Wang T., et al. (2023). Gut microbiota and its metabolic pathways modulate cardiovascular disease. Frontiers in Microbiology, 14:1176432. https://doi.org/10.3389/fmicb.2023.1272479
本文所用图片均为文献内Figure
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
