人为什么会变老?或许答案的一部分,藏在看不见的地方。近年的研究发现,人类体内那片肉眼不可见的生态系统——肠道微生物群,正在悄然影响我们老化的速度。我们习惯将衰老归因于基因、激素或氧化应激,却忽视了微生物这一“隐形器官”的作用。随着时间推移,这个系统的平衡被打破,衰老的脚步便开始加快。
2025年,《Genome Medicine》刊登的一篇综述提出了一个新概念——生物群老化(Biome-Aging)。研究者认为,肠道菌群的变化并非衰老的结果,而是参与其中的驱动力。随着年龄增长,益生菌群数量减少,潜在致病菌增多,肠壁屏障变得脆弱,炎症信号持续存在。这一连串微小的失衡,构成了“老化的微生态底色”。
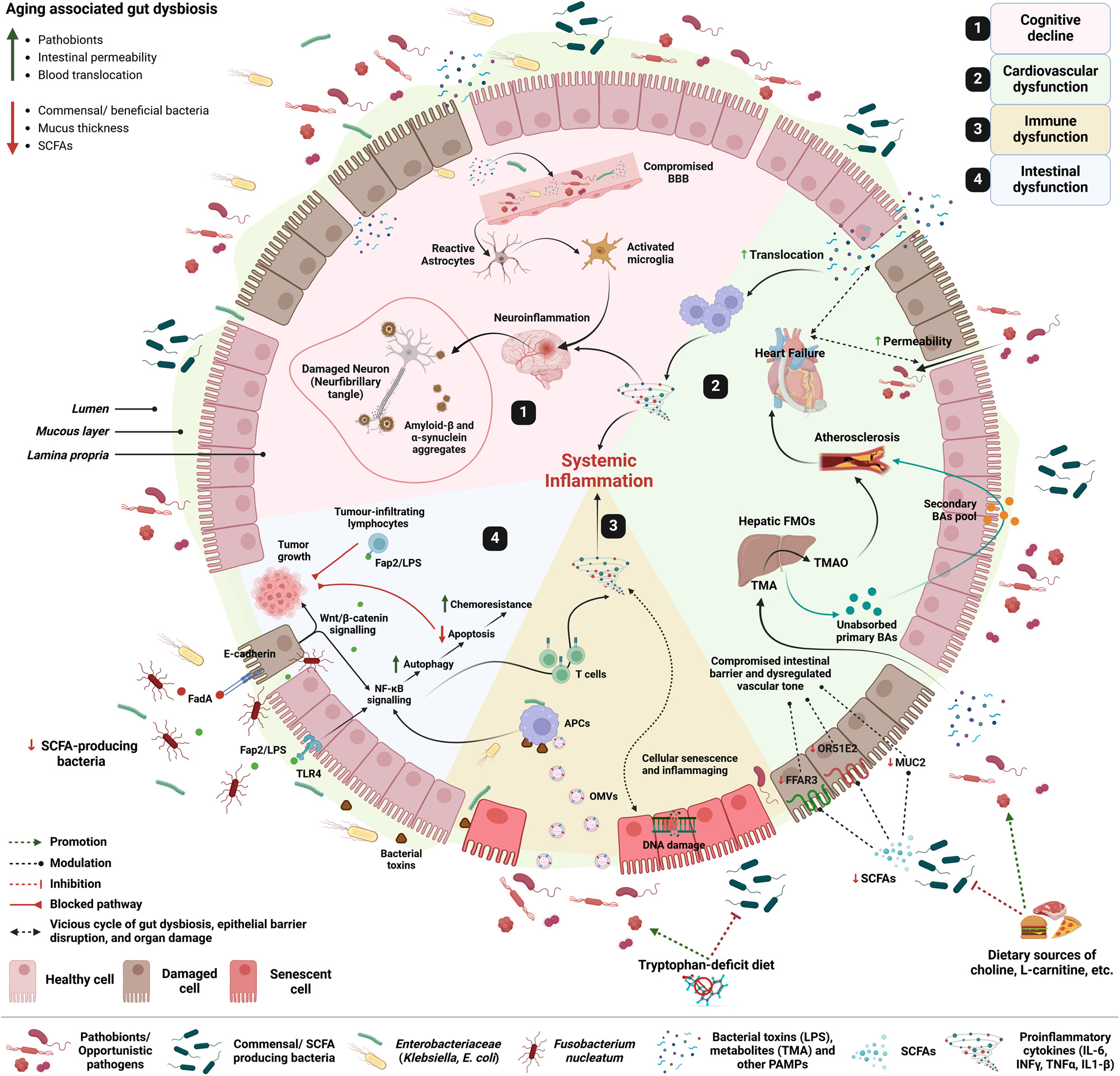
图1:论文中对“生物群老化”的概念示意。展示年龄、环境与生活方式如何通过微生态失衡促成炎症性衰老及系统性影响。
年轻的肠道就像一片繁盛的森林:短链脂肪酸(SCFAs)在其中循环,维生素和神经递质在这里合成,代谢、免疫与情绪彼此联动。到了中年之后,长期的高脂饮食、药物使用、精神压力以及激素波动,使生态逐渐退化。纤维摄入减少,SCFA产量下降,肠道通透性上升,毒素开始“越界”进入血液。体内炎症水平缓慢升高,形成所谓的“炎症性衰老(inflammaging)”,它几乎参与了所有与年龄相关的慢性疾病。
更复杂的是,这种变化并不局限于肠道。肠道与全身各系统通过神经、免疫、代谢信号相互牵连:当肠屏障被破坏,细菌脂多糖进入血液,可引发免疫细胞异常活化,加重心血管疾病风险;当代谢产物三甲胺氧化物(TMAO)升高,动脉粥样硬化的进程被加速;当炎症穿过血脑屏障,大脑中星形胶质细胞被激活,阿尔茨海默与帕金森病的风险显著增加。肌肉和骨骼同样受到影响——肠道菌群失衡会削弱钙吸收、抑制蛋白合成,导致骨质疏松与肌少症。衰老因此成为一个从肠道出发、向全身扩散的系统事件。
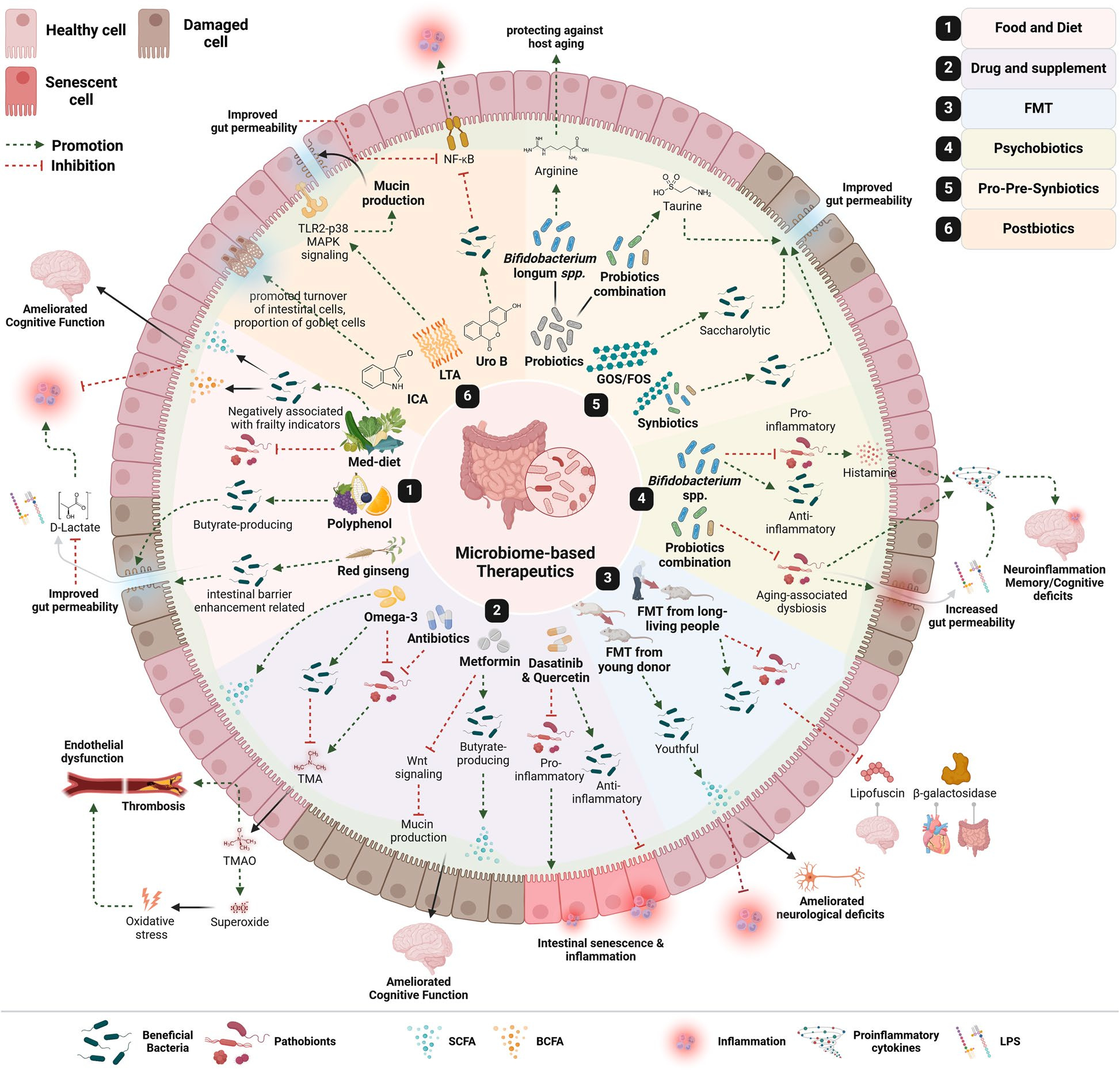
图2:论文中的系统性机制图。展示从肠漏、免疫激活到心血管、神经、骨骼肌等多系统老化的级联路径。
不过,生命的衰退并非必然一成不变。研究人员在百岁老人中发现了另一种可能:他们的肠道生态更接近年轻人。Christensenellaceae、Akkermansia muciniphila、Bifidobacterium 等菌群仍然丰富,能合成特殊的次级胆汁酸,抑制病原菌生长,保持抗炎环境。这些人似乎在无意间保留了“青春型菌群”,让体内生态系统比同龄人更稳定。这提示我们,长寿可能与特定的菌群结构密切相关。
既然菌群能随时间衰退,是否也能通过人为方式被“重启”?答案正逐步揭晓。饮食被认为是最基础也是最有效的干预途径:地中海式饮食富含膳食纤维、不饱和脂肪酸和多酚,可显著增加产丁酸菌如 Roseburia 和 Faecalibacterium 的数量,减少促炎菌群。蓝莓、绿茶、石榴等植物性食物中的多酚,能通过肠道代谢物间接调节免疫与代谢通路。长久遵循这样的饮食模式,可延缓老年虚弱的发生。
益生菌与益生元的研究则进一步揭示了微生态疗法的潜力:特定菌株组合(如 Lactobacillus plantarum、Bifidobacterium longum)能强化肠上皮紧密连接、提升黏液层厚度、降低炎症水平;益生元如低聚半乳糖(GOS)与抗性淀粉为益生菌提供“燃料”,与之协同改善微生态稳态。更有研究提示心理益生菌可改善老年人的睡眠与情绪障碍,提示“肠脑轴”也在衰老的心理层面发挥作用。
在更前沿的研究中,科学家开始关注后生元(Postbiotics)——由益生菌代谢产生的活性物质。乳酸菌细胞壁的脂磷壁酸可通过黏膜免疫通路减少肠漏;吲哚及其衍生物促进上皮更新、抑制炎症;尿石素B则调节氧化应激与免疫稳态。这类“无活菌疗法”兼具安全与稳定性,正成为食品与药物开发的重要方向。
最具颠覆性的探索来自“粪菌移植(FMT)”。将年轻个体的肠道菌群移植给老年动物,可重建肠道稳态、提升短链脂肪酸水平、改善学习记忆表现。若供体来自健康长寿者,效果更为显著。虽然距离临床广泛应用仍需时间,但这一思路正在改变我们对“重塑生命过程”的理解。
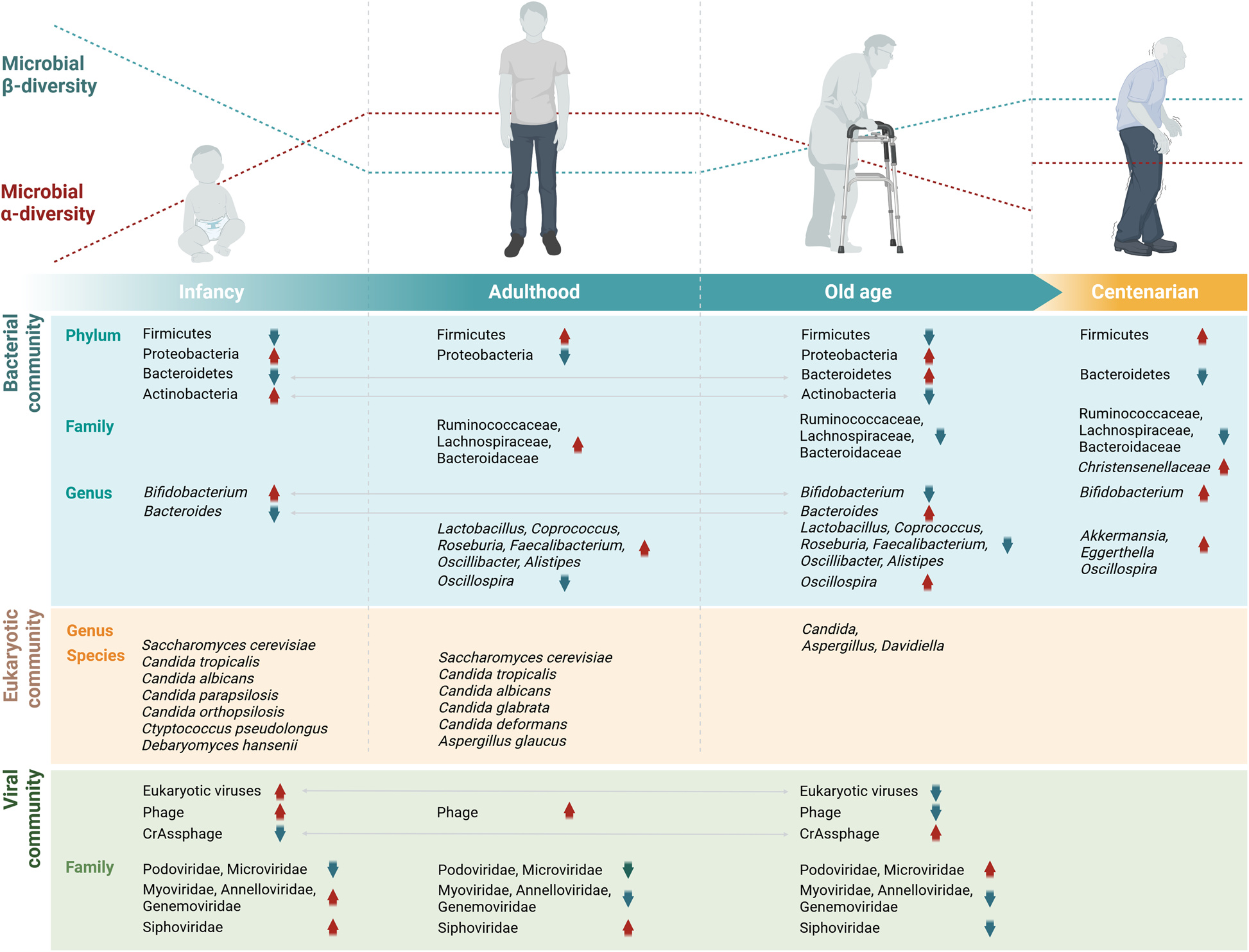
图3:论文对微生态治疗(饮食、益生菌/益生元、后生元、FMT 等)促进健康衰老与延长健康寿命的总体路径示意。
面对未来,抗衰老不再只是延长寿命,而是延长健康寿命。随着多组学与人工智能的介入,个体化“菌群指纹”将使干预更精准。肠道菌群或许终将成为一个可被调控的“器官”,而微生态疗法将是我们与衰老赛跑的新起点。
参考文献
Kadyan S, Park G, Singh T P, et al. Microbiome-based therapeutics towards healthier aging and longevity. Genome Medicine. 2025; 17:75.
本文所用图片均为文献内Figure
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
