同样是白米饭,有人吃后血糖飙升到 10 mmol/L,有人却几乎纹丝不动。
为什么会这样?是胰岛素分泌的差异,还是“碳水命运”的随机?
2025 年发表在 eBioMedicine 的一项系列 n-of-1 营养干预试验给出了更深层的答案——你的肠道菌群,可能正决定着一碗饭的命运。
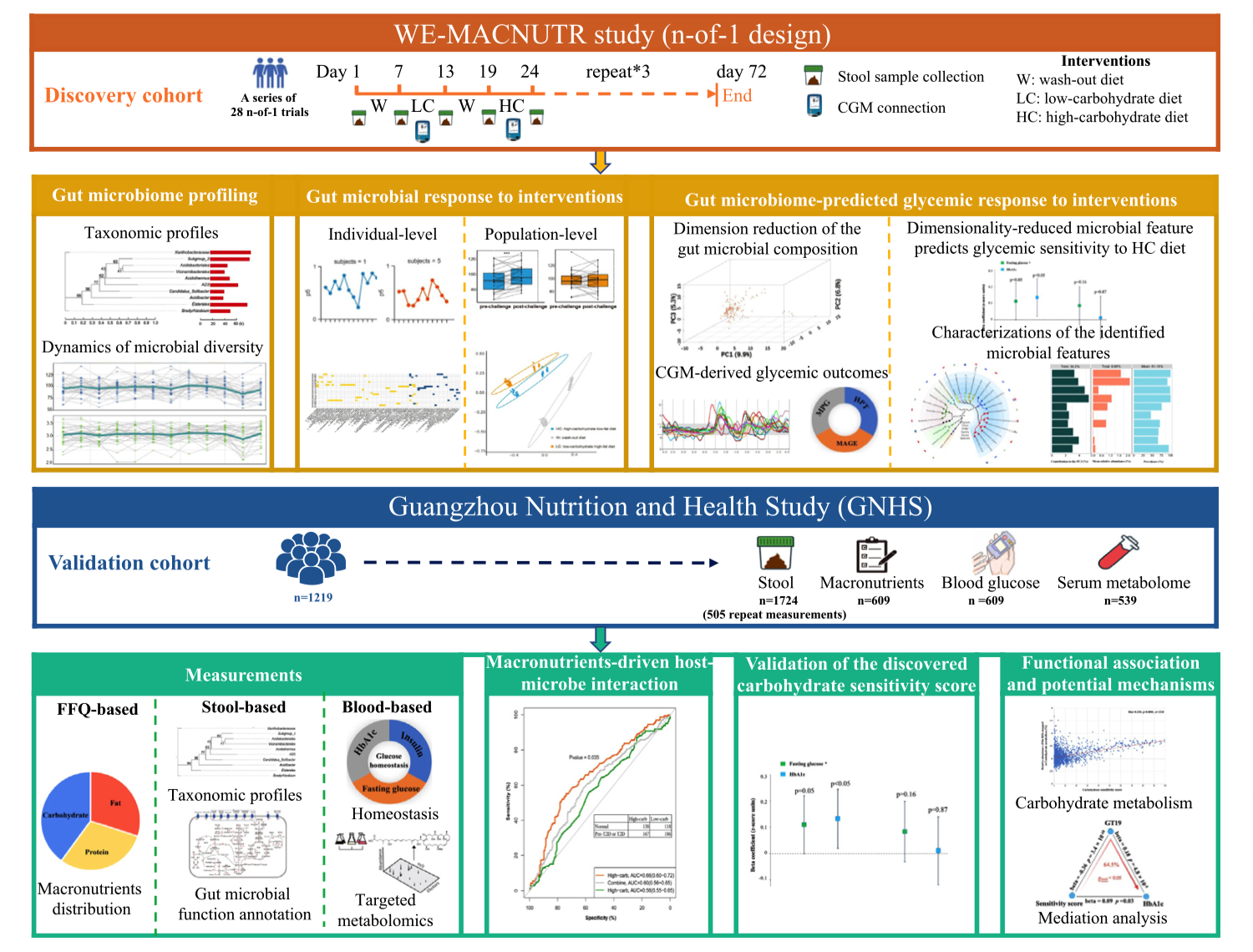
图1|研究设计:连续血糖监测、膳食记录与粪便菌群测序相结合的 n-of-1 营养实验框架。
这项研究由中国科学院与合作团队联合完成,入选对象为 60 余名健康成年人。研究者为每位参与者量身定制了多轮 “n-of-1 营养试验”:
即每个人都在自己身上进行交叉对照,轮流摄入不同类型的膳食(高脂、高碳、高纤维等),同时配戴 连续血糖监测仪(CGM),并每日采集粪便样本进行宏基因组测序。
研究目标是解析:个体的血糖反应差异,是否可以通过肠道菌群的组成与功能来预测。
结果显示,同样的食物,在不同人身上引起的血糖曲线差异巨大。
某些人对高碳水食物高度敏感,而另一些人几乎不受影响——这种差异无法用传统指标(BMI、胰岛素、脂肪肝指数等)解释。
但当研究者引入肠道微生物数据后,谜题被逐渐解开。
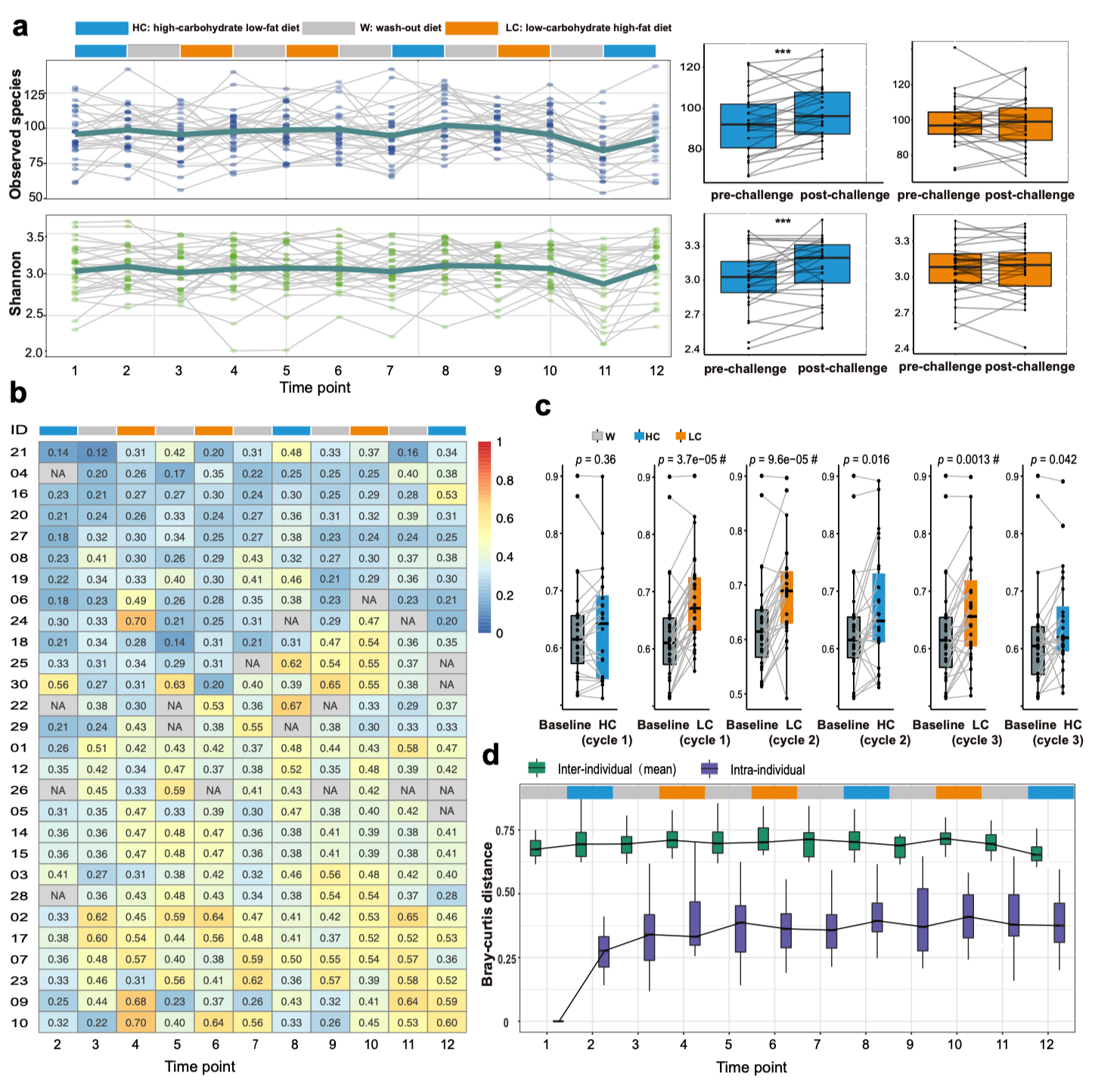
图2. 将肠道微生物代谢物与宿主葡萄糖稳态和胰岛素敏感性联系起来的概念模型.
研究团队发现:血糖反应“高敏组”的肠道菌群中,短链脂肪酸合成途径受抑、糖代谢相关基因活性高、部分产毒素菌(如 Clostridium 属)比例上升;
而“平稳组”则富含 产丁酸菌(如 Faecalibacterium prausnitzii)与产丙酸菌,这些菌通过产酸降低肠道 pH、改善屏障、并间接调节胰岛素信号。
更重要的是,研究者建立的机器学习模型表明,仅凭菌群功能谱(metagenomic pathways)即可预测个体餐后血糖曲线的 60% 方差——超过任何临床参数。
换句话说,肠道菌群的“代谢签名”比热量计算更能解释血糖反应。
这意味着“吃同样的饭不一样胖”并非命,而是可被科学量化与干预的系统现象。
在机制层面,研究者提出了一个三步假说:
① 饮食成分经肠道微生物代谢,生成短链脂肪酸、支链氨基酸及其他代谢物;
② 这些分子通过肠屏障进入循环,影响肝脏糖异生与胰岛素敏感性;
③ 最终反馈到血糖曲线的个体差异上。
因此,肠道菌群是连接“吃什么”和“血糖怎样变”的中介层。
进一步的纵向随访还发现,若个体根据其“菌群反应谱”调整饮食结构(例如增加膳食纤维、减少可发酵糖),可在 2 周内显著降低血糖波动幅度,改善平均血糖暴露(MAGE)指标。
这为“精准营养”(precision nutrition)提供了量化依据:未来的饮食建议不再是‘每个人每天 2000 千卡’,而是‘根据你的菌群反应调整膳食’。
结语
这项研究提醒我们:食物的效应并非由热量表决定,而是由肠道菌群的代谢网络决定。
它将饮食科学从“统计学平均”推进到“生物个体化”的新阶段——每个人的“最佳饮食”,都写在自己肠道微生物的基因里。
参考文献
Zhang Y, et al. Diet–gut microbiome interaction and its impact on host blood glucose homeostasis: a series of nutritional n-of-1 trials. eBioMedicine. 2025;103:105234. doi:10.1016/j.ebiom.2024.105234.
本文所用图片均为文献内Figure
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
