同样的饮食,有人能量满格、精神充沛,有人却血糖波动、脂肪堆积。
现代代谢医学正在重新定义这一切:人体的能量秩序,不仅由胰岛素、肝脏或基因决定,更由肠道那座“微生物城市”协同治理。
2020 年发表于 Nature Reviews Microbiology 的权威综述《Gut microbiota in human metabolic health and disease》指出,肠道菌群几乎参与了所有代谢健康的关键环节——从能量摄取、营养吸收,到炎症调控和激素信号。在健康状态下,这座微生物城市运转有序。菌群将膳食纤维发酵为短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,后者能刺激肠道 L 细胞分泌 GLP‑1 和 PYY,抑制食欲、提高胰岛素敏感性;
同时,菌群代谢胆汁酸,激活 FXR 与 TGR5 受体,促进脂质代谢与肝糖输出调节。
吲哚类代谢物还能通过芳香烃受体(AhR)维持肠屏障完整,防止炎症信号扩散。
可以说,健康菌群让能量分配“井然有序”,既不过量储存,也不浪费燃料。
然而,一旦生态失衡,城市就陷入“代谢紊乱”。
高脂饮食、抗生素或久坐生活方式可破坏菌群多样性,造成短链脂肪酸产量下降、内毒素(LPS)渗漏增加、肠屏障受损,引发慢性低度炎症。
这类炎症激活巨噬细胞与脂肪组织信号通路,降低胰岛素敏感性,并推动脂肪在肝脏与肌肉中的异常堆积。
研究者发现,肥胖、2 型糖尿病与非酒精性脂肪肝患者普遍呈现“微生物功能退化”现象——不仅种类减少,更重要的是功能丧失。
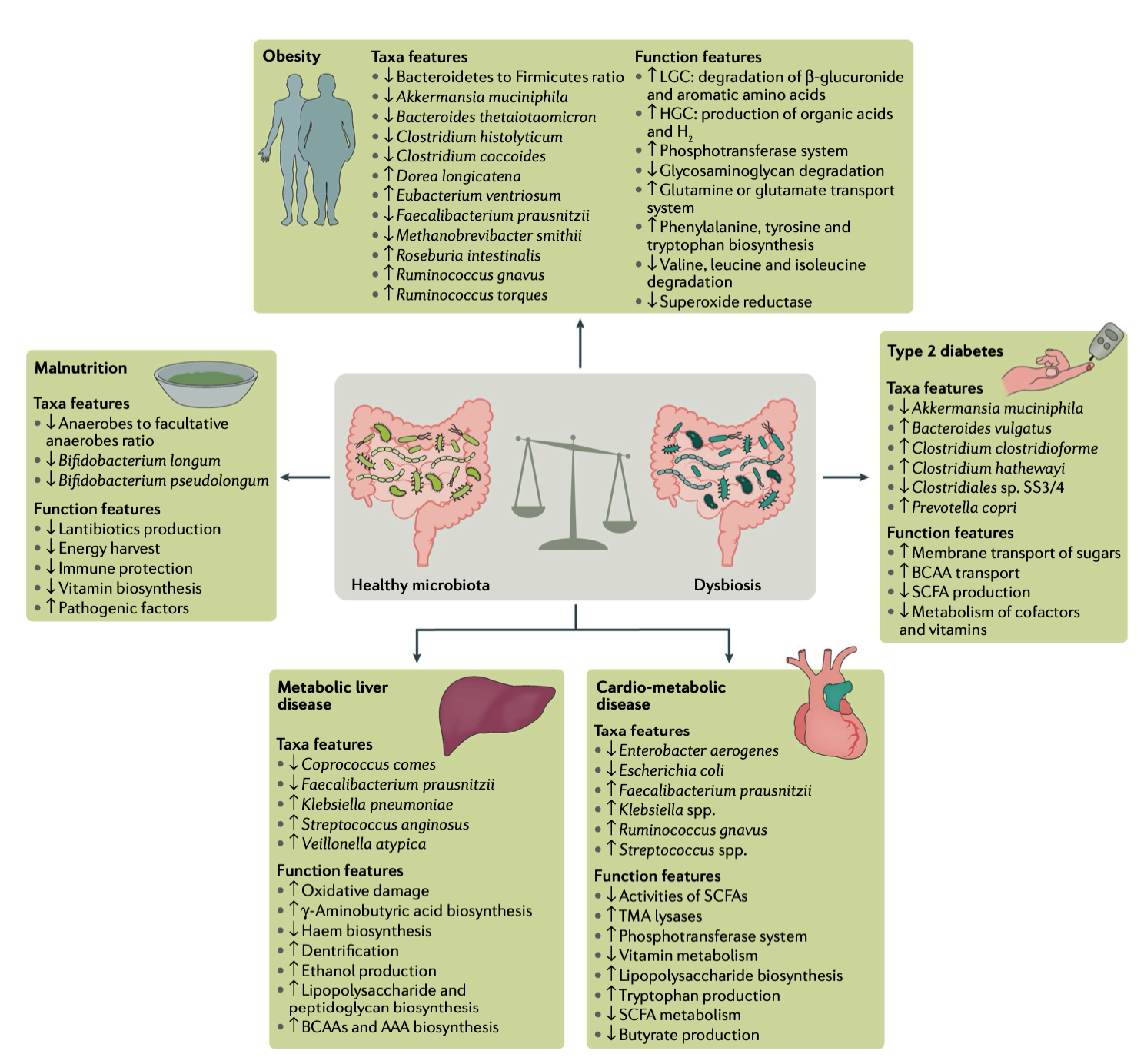
图1 一些与常见代谢紊乱相关的报道的肠道微生物分类学和功能特征。
例如,肥胖人群中产丁酸菌(Faecalibacterium prausnitzii、Roseburia)显著减少,而能分解黏液层的 Akkermansia muciniphila 缺乏;
2 型糖尿病患者体内,支链氨基酸合成菌增多,导致血中 BCAA 升高,与胰岛素抵抗密切相关;
心血管代谢病患者体内,菌群可将膳食胆碱、左旋肉碱转化为三甲胺(TMA),再由肝脏生成 TMAO,这种代谢物能促进动脉粥样硬化。
甚至在营养不良与恶病质中,菌群的氨基酸与脂肪代谢功能同样失调,进一步削弱能量供应。
这些发现构成了“代谢微生态学”的核心:代谢疾病不是器官孤立的病,而是宿主–微生物共生系统的系统性失衡。
健康菌群帮助我们“节能增效”,失衡菌群则让身体陷入“慢性过载”。
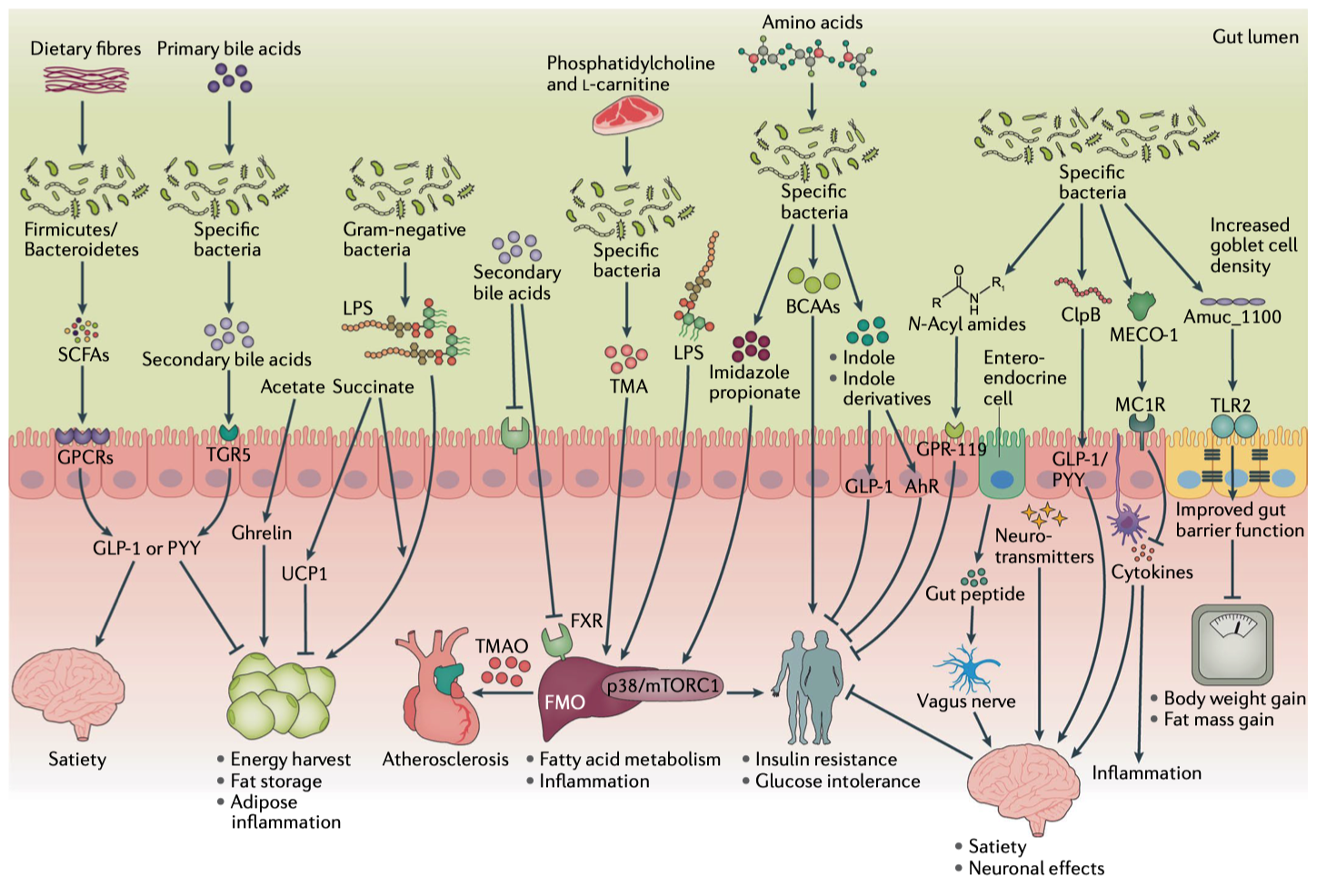
图2|肠道微生物代谢信号网络与宿主能量代谢通路。
在分子层面,菌群通过多条代谢信号线影响全身:
●短链脂肪酸(SCFAs):调节脂肪氧化、葡萄糖代谢与肠激素;
●胆汁酸与次级胆汁酸:影响 FXR/TGR5 信号与能量消耗;
●支链氨基酸(BCAA):与胰岛素抵抗、肥胖密切相关;
●吲哚衍生物与酚酸:维护肠屏障与抗炎平衡;
●LPS 与TMAO:引发代谢炎症与动脉粥样硬化风险。
研究者提出,未来的代谢病治疗将走向“微生物靶向化”:
包括益生元与定制膳食干预、特定菌株补充(如 Akkermansia、Christensenella)、微生物群移植(FMT)、噬菌体调控,以及基于 CRISPR 的精准重编程。
这些策略的目标,不再是简单“杀菌或喂菌”,而是重塑肠道生态的功能平衡。
结语
我们的代谢并非孤立的生化反应,而是微生物与人类共同书写的能量账本。
在未来医学中,理解这座“微生物城市”的交通规则,或许才是恢复代谢秩序、延缓衰老与疾病的关键。
参考文献
Pedersen HK, Fan Y. Gut microbiota in human metabolic health and disease. Nature Reviews Microbiology. 2020;18(9):544–558. doi:10.1038/s41579-020-0433-9.
本文所用图片均为文献内Figure
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
