一、引言:一场骨骼与血管的“钙爱”剧变
如果把人体比作一座城市,骨骼是支撑摩天大楼的钢筋,血管则是贯穿全城的输水管。两者看似井水不犯河水,却在“钙”这个关键角色上上演着狗血剧情——骨质疏松(骨头变脆)和血管钙化(血管变硬)这对“老年CP”(CP是英文“Character Pairing”的缩写,意指人物配对),总爱在同一个屋檐下搞事情。
更离奇的是,当骨骼里的钙悄悄“私奔”到血管壁定居,这场“钙的背叛”竟让医生们抓耳挠腮:为何补钙防骨质疏松的同时可能加速血管硬化?为何治疗骨质疏松的新药洛莫索珠单抗(Romosozumab),竟被怀疑“脚踩两只船”增加心脏病风险?今天我们就来扒一扒这场“钙爱罗曼史”背后的生物力学科学八卦。
二、钙的“双向失守”
骨骼是人体的 “钢筋架构”,为身体提供支撑与保护;血管则是输送营养与氧气的 “管道网络”。正常情况下,钙在骨骼中稳定沉淀,维持骨骼强度;在血管中保持低浓度,保障血管弹性。然而,当钙的代谢平衡被打破,骨骼开始 “钙流失” 陷入骨质疏松,血管却 “钙过载” 出现钙化,这就如同一场钙在骨骼与血管之间的 “情感出轨”。骨骼与血管的 “钙爱” 演变成了“钙的错爱”。
1. 骨头的“家贼难防”
如果把骨骼想象成一个24小时施工的工地,那么成骨细胞是勤恳的“建筑工人”,破骨细胞是拆迁办派来的“拆墙狂魔”(图1)。
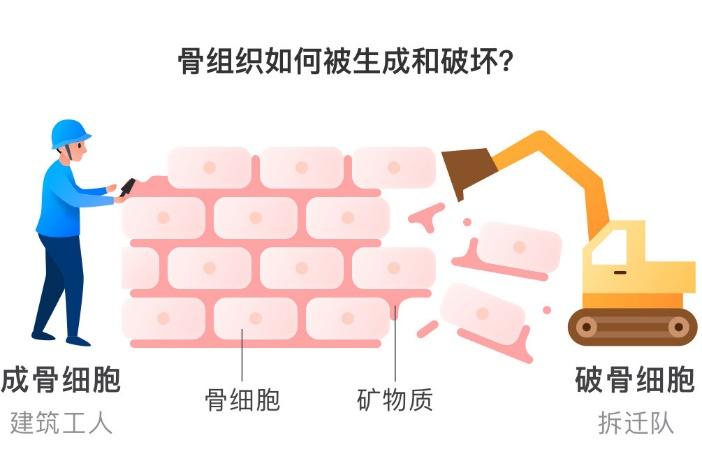
图1 成骨细胞与破骨细胞的作用
正常情况下两队人马势均力敌,但更年期后雌激素撤退、慢性炎症偷袭时,“拆迁队”突然获得神秘力量加持,骨质疏松加速发展。
研究显示,50岁以上女性每5人就有1人骨质疏松,髋部骨折后1年内死亡率高达20%。这些触目惊心的数字背后,是破骨细胞狂欢式“拆楼”,把钙质“洗劫一空”后装车运往血液的高速公路。
关于髋部骨折后的致命后果,还有惊心动魄的故事。延伸阅读,请关注我的个人微信公众号“医用生物力学”的文章:人生的最后一次跌倒。
2. 血管的“引狼入室”
当血液里游荡的钙离子浓度超标,血管壁的“保安”——血管平滑肌细胞(VSMCs)开始作妖。它们被炎症因子“灌醉”后,突然觉醒“第二人格”,从肌肉细胞叛变转职成“钙化工程师”,分泌羟基磷灰石,搭建钙化斑块,结果是造成血管硬化、堵塞等严重病变后果。
更绝的是,这些叛变细胞还会释放“求救信号”——携带多种信号分子的胞外囊泡。它们就像“特洛伊木马”,隐秘地溜回骨髓,忽悠间充质干细胞放弃造骨,转行囤积脂肪,完美演绎了什么叫“吃里扒外”,结果是促进骨质疏松进一步发展等不良后果(图2)。
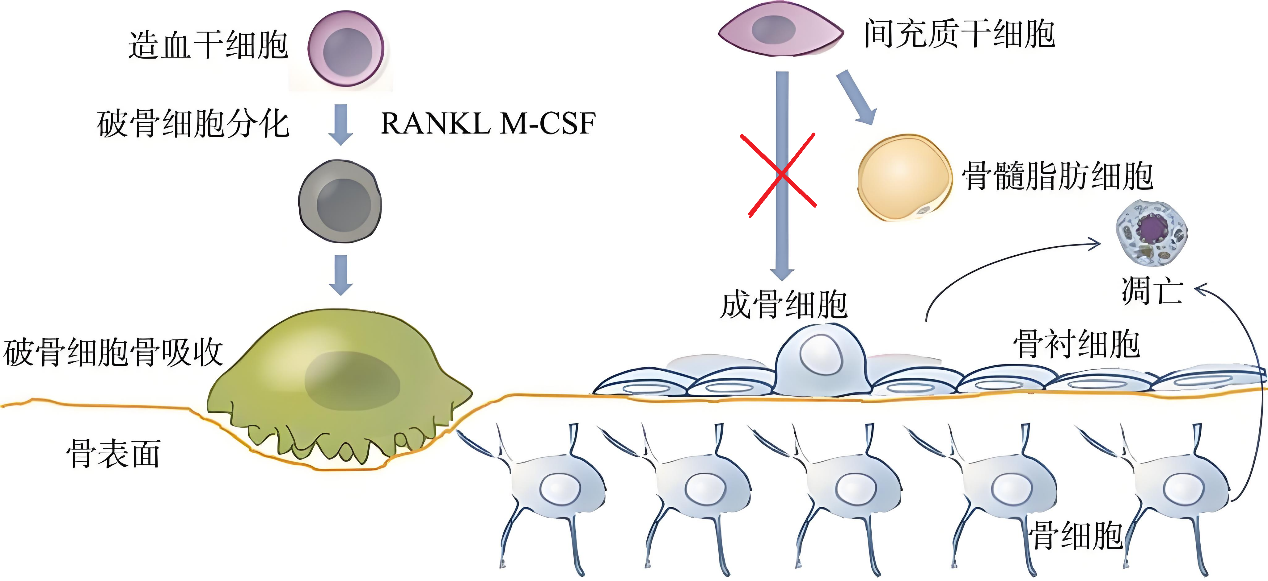
图2 成骨细胞与破骨细胞的作用
关于骨质疏松与血管钙化的“钙爱罗曼史”,还有丰富多彩的描述。延伸阅读,请关注我的个人微信公众号“医用生物力学”的文章:骨与血管的“钙化悖论”。
三、分子级的“谍战”
1. RANKL-RANK-OPG:钙代谢“三角关系”
骨骼的完整性由不断重复、时空偶联的骨吸收和骨形成过程维持,此过程称为骨重建。绝经前女性骨保护素(osteoprotegerin,OPG)和核因子-κB受体活化因子配体(receptor activator of NF-kappa B ligand,RANKL)处于平衡状态,成骨细胞分泌的OPG能够结合部分RANKL,从而使经RANKL与破骨细胞前体及破骨细胞表面核因子-κB受体活化因子受体(receptor activator of NF-kappa B,RANK)结合引起的破骨细胞分化、激活以及骨吸收可以被成骨细胞的骨形成作用所代偿。由此,骨吸收和骨形成得以平衡,骨密度和骨强度得以维持(图3)。
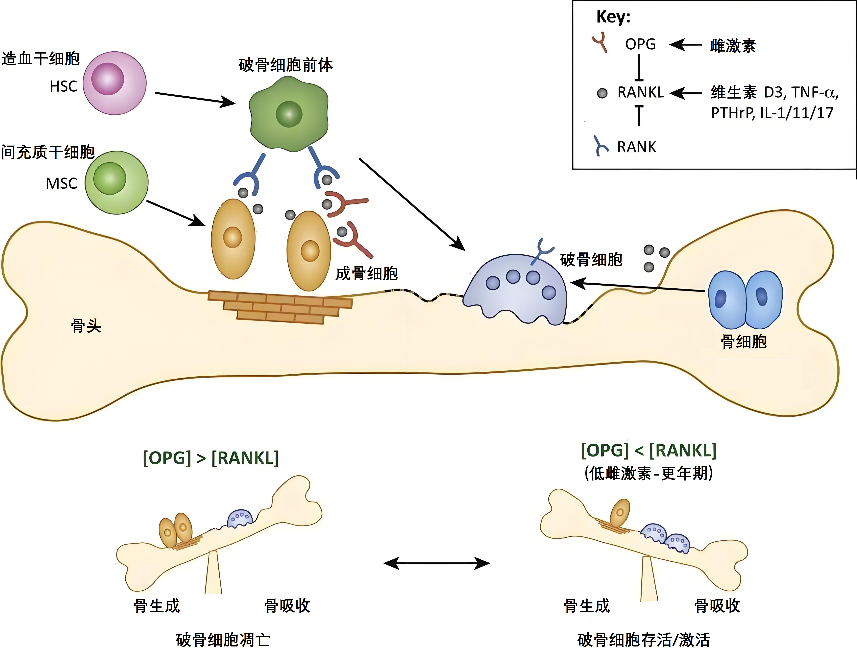
图3 RANKL-RANK-OPG:钙代谢“三角关系”
RANKL(配体):成骨细胞派出的“双面间谍”,表面协助骨骼更新,暗地激活破骨细胞搞破坏。
RANK(受体):破骨细胞表面的“接收天线”,与RANKL结合后启动拆骨程序。
OPG(诱饵受体):骨骼安插的“反间谍装置”,专门拦截RANKL防止其作妖。
这个“三角恋”在血管里同样精彩。钙化斑块中RANKL表达量飙升3倍以上,诱导VSMCs变身“钙化特工”。而OPG就像及时赶到的拆弹专家,能降低血管钙化风险达40%。
2. Wnt通路:命运的“双刃剑”
Wnt信号堪称骨骼界的“成功学导师”,能激励干细胞变身成骨细胞。但它的死对头——硬骨素(sclerostin)总爱泼冷水。这个由骨细胞分泌的“职场PUA大师”,通过抑制Wnt通路让成骨细胞集体躺平(图4)。
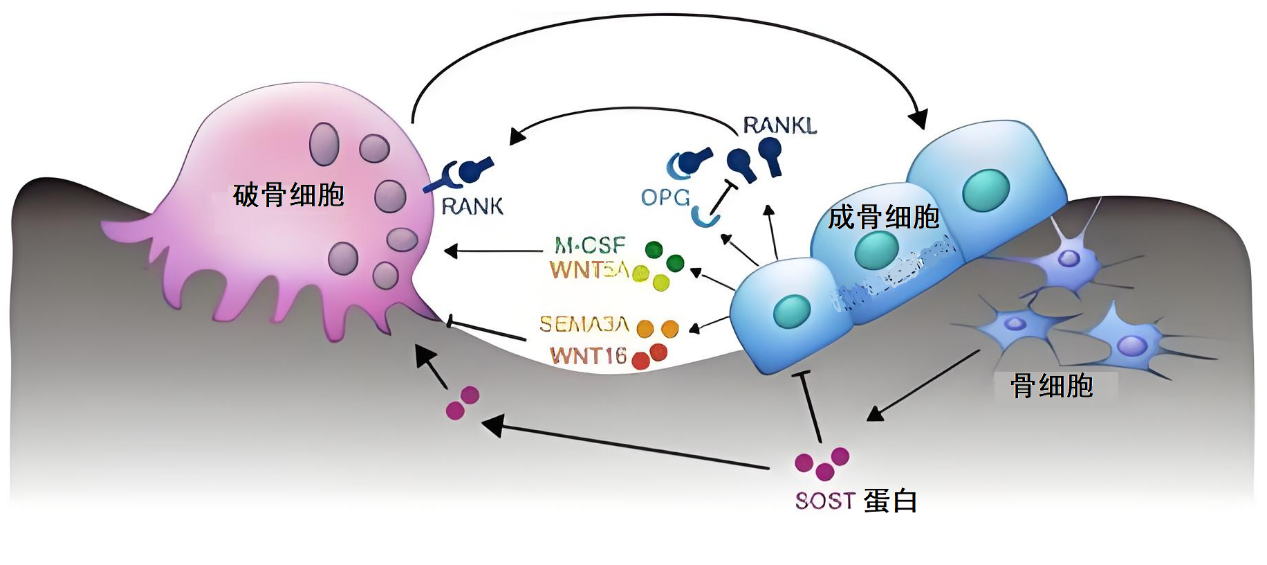 图4 骨骼界的“成功学导师”Wnt信号
图4 骨骼界的“成功学导师”Wnt信号
戏剧性的是,当血管开始钙化,VSMCs竟也学会分泌硬骨素!动物实验显示,敲除硬骨素基因的小鼠血管钙化面积减少60%,但骨骼强度却提升30%。这让人不禁怀疑:硬骨素到底是血管的“守护天使”,还是潜伏的“双面卧底”?
四、药物界的“无间道”
1. Romosozumab:天使还是魔鬼?
Romosozumab这个靶向硬骨素的单抗药物堪称骨质疏松治疗的"当红炸子鸡"。它通过阻断硬骨素对Wnt通路的压制,实现“一箭双雕”:骨形成速度提升80%(对照组仅15%);椎体骨折风险降低73%。
但2022年《新英格兰医学杂志》爆出猛料:使用该药的患者心血管事件风险增加31%。科学家们至今没搞懂,这个“骨骼救星”为何突然在心血管系统“黑化”,它到底是个怎样“软硬通吃”的家伙。
2. 双膦酸盐:老牌特工的“暗度陈仓”
作为骨质疏松经典药物,双膦酸盐家族(如阿仑膦酸钠)不仅能抑制破骨细胞,最新研究显示它们还能截获衰老骨细胞发出的“破坏指令”——携带miRNA的胞外囊泡。这种“情报拦截”使血管钙化风险降低22%,堪称药物界的“双向维稳专家”。
五、科学家们的“破案现场”
1. 世纪难题:补钙到底补哪儿?
补钙悖论:每天补钙>2000 mg,心血管事件风险激增20%。
维生素K2:这个“钙质交警”能指挥89%的钙定向沉积骨骼,同时激活血管壁的“排钙蛋白”基质Gla蛋白。
运动玄机:每天30分钟负重运动,既能通过机械应力刺激骨形成,又能通过改善血流剪切力抑制血管钙化。
2. 代谢迷局:FGF23的“分身术”
成纤维细胞生长因子23(FGF23)本是调节血磷的“好同志”,但在慢性肾病晚期会突然“黑化”。它一边抑制肾脏重吸收磷(导致低血磷性骨病),一边激活血管壁的ERK信号通路(加速钙化),完美诠释了什么叫“代谢精神分裂”。
3. 未来医疗的“破局之路”
精准补钙计划:结合CT血管钙化评分+骨密度检测+尿液钙磷监测,制定个性化方案。
双通路狙击手:研发同时靶向RANKL和Wnt通路的双功能抗体,目前已有候选药物在小鼠实验中将骨密度提升45%,血管钙化减少38%。
细胞快递系统:利用工程化外泌体,向血管精准投递OPG蛋白或miRNA抑制剂。
正如2023年《自然》杂志评论所言:“解开骨-血管轴奥秘,需要工程师的巧手、侦探的慧眼,以及编剧的想象力”。或许不久的将来,我们能像调解家庭纠纷一样,让骨骼和血管这对“欢喜冤家”握手言和(图5)。

图5 “骨-血管轴”,本是同根生,相煎何太急
六、小结
不管是骨头出了轨,还是血管劈了腿,骨质疏松(骨钙流失)和血管钙化(钙沉积血管)看似对立,实则共享相同的分子生物力学机制,如RANKL-RANK-OPG通路和Wnt信号通路。硬骨素(sclerostin)是调控两者的关键蛋白,既能抑制骨形成,又参与血管钙化。抗骨质疏松药物Romosozumab虽能强效增骨,却可能增加心血管风险,凸显治疗矛盾。补钙需谨慎,过量可能加剧血管钙化,而维生素K2和运动可协同保护骨骼与血管。未来需开发双靶点药物,精准调控“骨-血管轴”,实现“一石二鸟”的治疗策略。科学调理钙代谢,才能让骨骼和血管“和平共处”。
记住:当身体开始“钙的背叛”,科学调理就是最好的“婚姻咨询师”!
来源: 医用生物力学


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助

