中药抗癌新突破!广中医团队首次发现金蓉颗粒的抗癌密码,登上国际顶刊!
在现代社会,癌症已经成为威胁人类健康的重大疾病之一,转移复发是导致肿瘤临床治疗失败及多少癌症死亡的主要原因,它极大地降低了患者的生存率和生活质量。据统计,90%以上的乳腺癌患者死亡是由肿瘤转移造成的,转移部位多见肺、骨、脑。同时约6%的患者最初被诊断为转移性乳腺癌,20%-50%的原发性乳腺癌在首次确诊后3-10年或更长时间会发生远处转移,部分患者肿瘤发生早期在血液和骨髓中即可检测到循环癌细胞的存在。
在抗癌的研究道路上,传统中药常常能给科学家们带来意想不到的启示。广州中医药大学研究团队从创新中药金蓉颗粒中揪出关键抗癌密码——宝藿苷I(BHS),首次揭示其通过改造肿瘤微环境,抑制乳腺癌转移的全新机制。这项名为“Baohuoside i suppresses breast cancer metastasis by downregulating the tumor-associated macrophages/C-X-C motif chemokine ligand 1 pathway”的研究登上国际权威期刊《Phytomedicine》,该研究为乳腺癌治疗提供了新型候选药物,不仅为乳腺癌患者带来新希望,更让世界看到中医药现代化的典范。

图1 论文首页
以往研究表明,金蓉颗粒可以通过调节肿瘤相关巨噬细胞(TAMs)/C-X-C基序趋化因子配体1(CXCL1)途径,显著抑制乳腺癌转移。TAMs和CXCL1在乳腺癌转移过程中扮演着重要的角色。TAMs原本是身体免疫系统的一部分,但在肿瘤微环境中帮助癌细胞生长、转移。而CXCL1能够吸引癌细胞向周围组织和远处器官转移。然而,金蓉颗粒是由多种中药成分组成的复杂混合物,其中究竟是哪种成分在发挥抗转移的作用仍不清楚。
一、活性成分精准锁定
研究通过生物活性导向分离技术,经过大量的实验和筛选,终于发现了一种关键的生物活性成分——宝藿苷I(BHS)。质谱与核磁共振分析显示,宝藿苷I能显著降低TAMs中CXCL1的转录与分泌(p IC50 > 10 μM)。而且结果显示宝藿苷I在低浓度(2×10 μm)同样能显著抑制乳腺癌细胞系BT549和4T1的集落形成能力,表明金蓉颗粒可以在长期给药后抑制乳腺癌细胞的增殖(图2B)
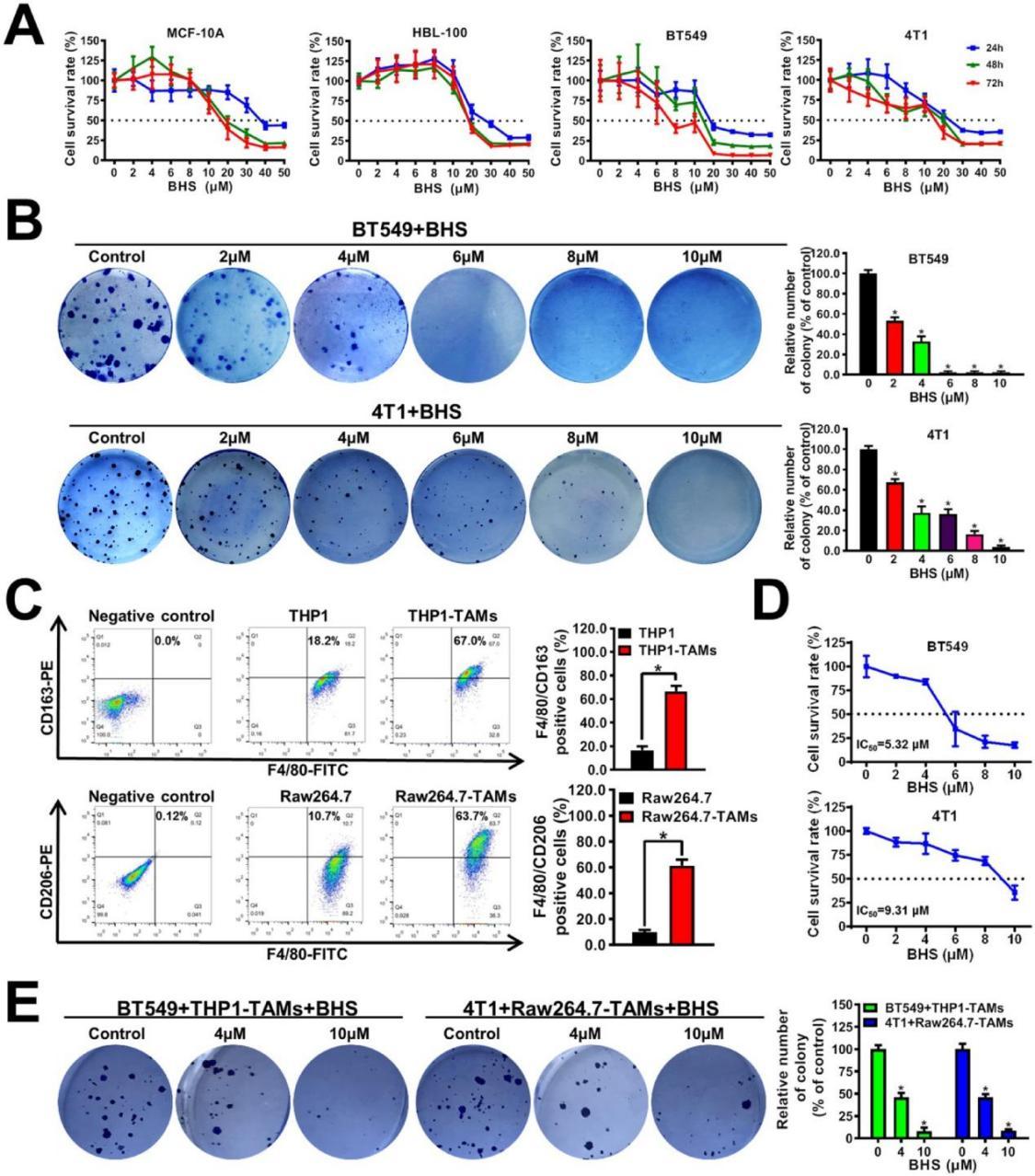
图2 BHS显著抑制共培养系统中乳腺癌细胞的生长。
二、多重抗转移机制
以往研究发现肿瘤微环境中的肿瘤相关巨噬细胞(TAMs)就像癌细胞的"保镖",它们分泌的CXCL1趋化因子会:
➤ 开绿灯:激活癌细胞迁移、侵袭能力,促进癌细胞扩散;
➤ 养精兵:增加癌症干细胞比例,增强癌细胞干细胞特性(导致复发耐药);
➤ 建屏障:形成免疫抑制微环境(让化疗失效)。
而金蓉颗粒中的宝藿苷I能够“多管齐下”,具有多种策略:
1、正面直接作用:抑制乳腺癌细胞迁移、侵袭及干细胞特性
研究发现BHS可以显著抑制BT549和4T1细胞的迁移和侵袭能力。同时,BHS还显著消除了TAMs-CM 对乳腺癌细胞迁移和侵袭的促进作用(图 4A-B)。BHS显著降低了BT549细胞和 4T1细胞中的ALDH+亚群的数量,而TAMs-CM显著增加了这些群体的数量,表明 BHS可以抑制乳腺CSCs的自我更新,而TAMs-CM(培养基)可以促进乳腺CSCs的自我更新。同时,BHS还显著消除了TAMs-CM对乳腺CSCs自我更新的促进作用(图4C)。此外,BHS显著减弱了BT549和4T1细胞中包括波形蛋白(Vimentin)和MMP2在内的转移相关蛋白的表达水平,而TAMs-CM达到了相反的效果,表明 BHS可以抑制乳腺癌转移,而TAMs-CM可以促进乳腺癌转移。此外,BHS显著逆转了TAMs-CM对乳腺癌细胞中转移相关蛋白的上调作用(图 4D)。总之,即使在 TAMs存在的情况下,BHS也可以在体外抑制乳腺癌转移。
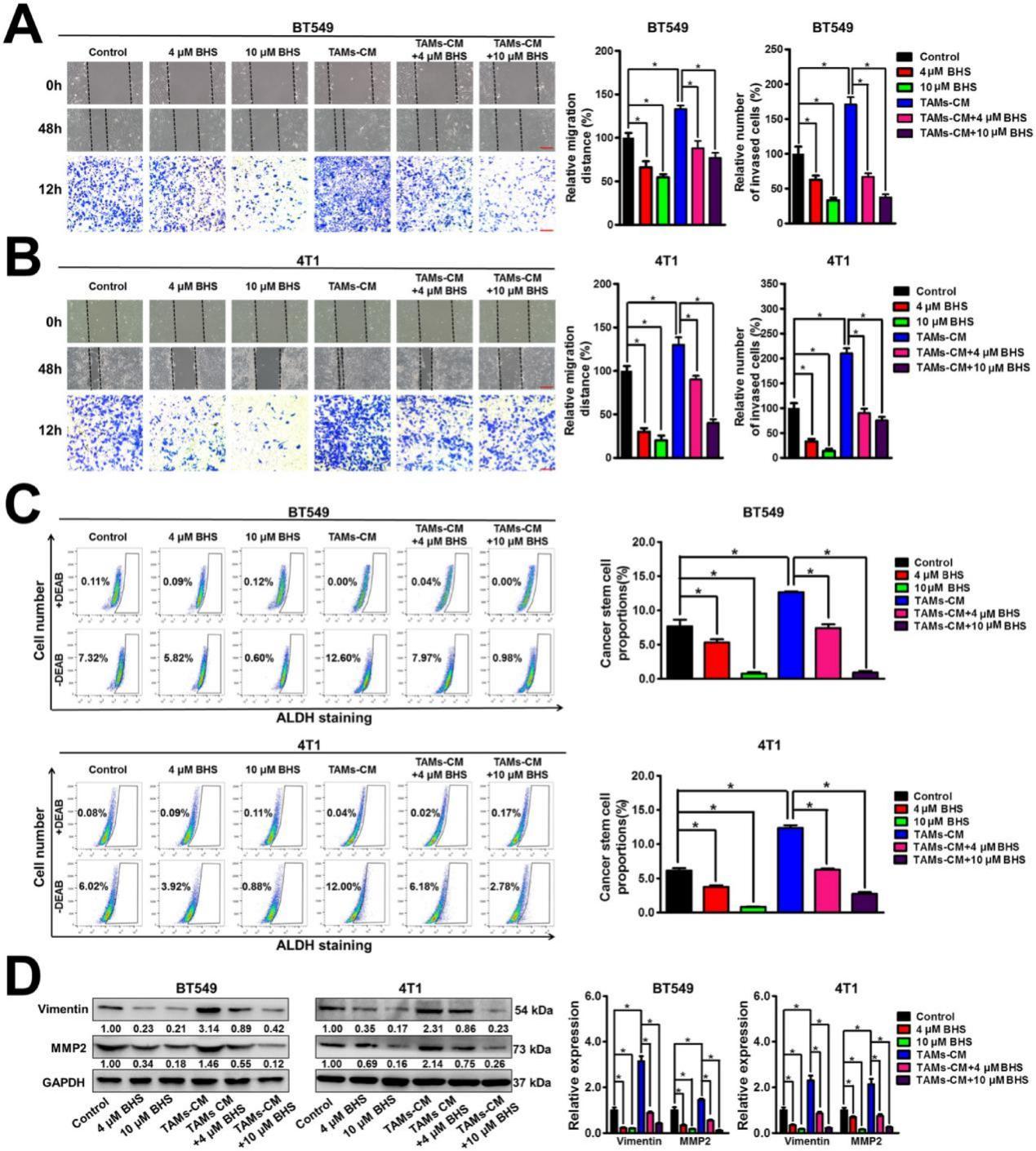
图3.BHS显著抑制TAMs诱导的乳腺癌细胞转移。
2、阻断后援并策反敌军:在抑制TAMs的M2表型极化,同时将促癌的M2型巨噬细胞逆转为抗肿瘤的M1型。
TAMs有两种不同的表型,即M1表型和M2表型。M1表型的TAMs能够攻击和消灭癌细胞;而M2表型的TAMs会促进癌细胞的生长和转移。低浓度的BHS能显著消除TAMs-CM对乳腺癌细胞增殖和转移的促进作用。进一步实验表明,BHS可以剂量依赖性地逆转TAMs的M2表型极化(图3B)。这意味着BHS能够改变TAMs的状态,使其朝着不利于肿瘤生长和转移的方向发展。同时宝藿苷I能够抑制TAMs向M2表型极化,为抑制乳腺癌的进展提供了一种潜在的干预途径。
3、关闭癌细胞“指挥部”,切断军令信号:抑制TAMs分泌,减弱CXCL1的表达和分泌,使癌细胞失去转移指令。
TAMs的分泌功能在乳腺癌的发生、发展中起着关键作用。酶联免疫吸附试验分析表明,BHS还以剂量依赖性方式显著抑制TAMs分泌CXCL1(图3C)。除了抑制CXCL1的分泌,BHS还可能对TAMs分泌的其他促肿瘤因子产生影响。通过调节TAMs的分泌,BHS可以整体改善肿瘤微环境,抑制乳腺癌细胞的转移。
CXCL1是癌细胞转移的信号,它的异常表达和分泌会促进乳腺癌细胞的增殖和转移。宝藿苷I能够以剂量依赖性方式显著抑制TAMs中CXCL1的表达和分泌。同时,BHS还抑制了CXCL1基因的启动子活性,从源头减少了CXCL1的产生(图3D-F),为乳腺癌治疗提供了新的靶点。
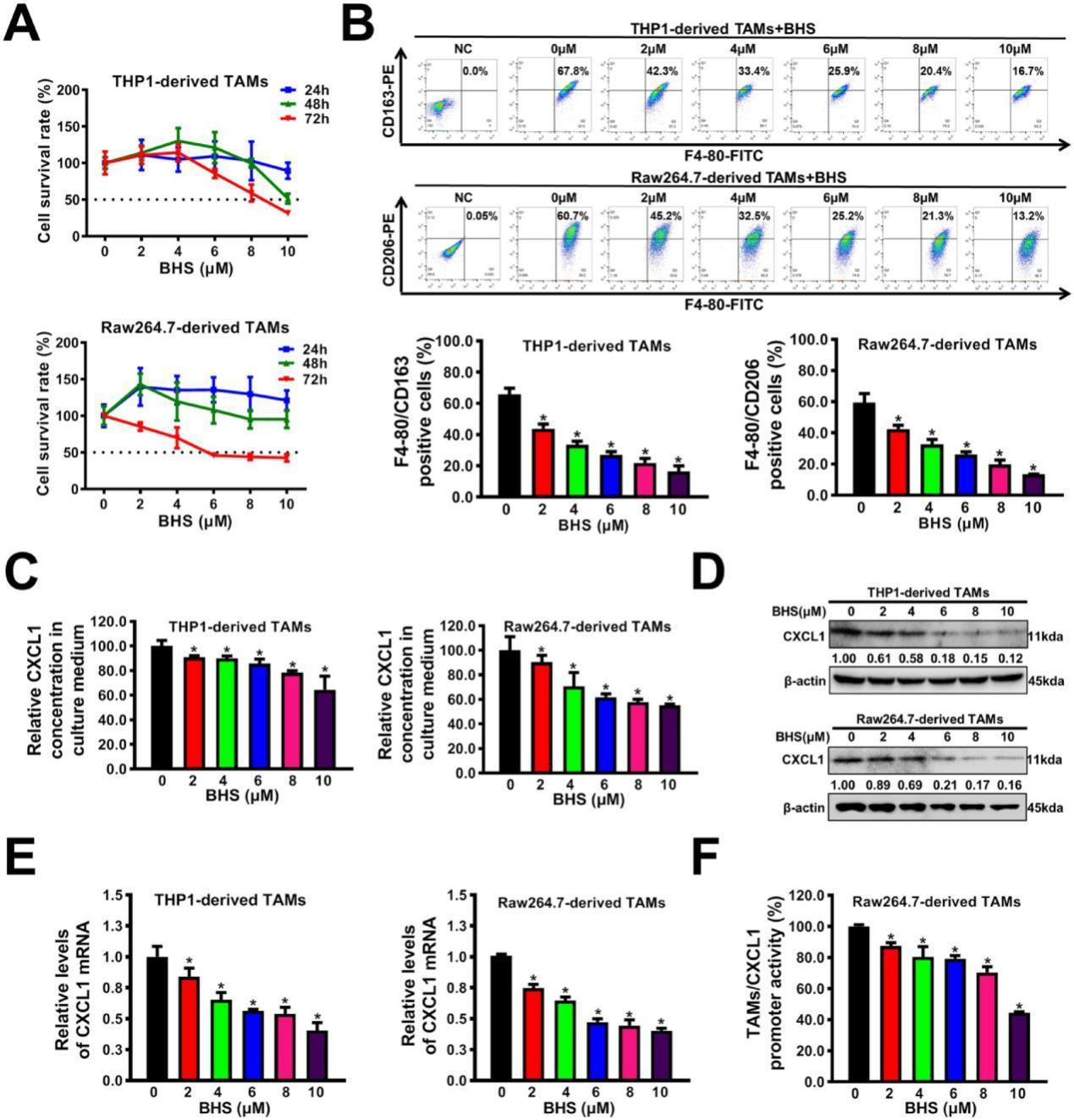
图4.BHS抑制M2表型极化、CXCL1表达和TAMs的分泌。
三、体内外高效验证
在动物实验方面,研究建立了斑马鱼乳腺癌异种移植模型和小鼠乳腺癌异种移植物模型。通过流式细胞术、组织免疫荧光等方法,结果发现,宝藿苷I能够显著抑制斑马鱼和小鼠体内乳腺癌的生长和转移以及TAMs/CXCL1活性。这些实验结果充分证明了宝藿苷I具有强大的抗乳腺癌转移能力。并且发现宝藿苷I在斑马鱼胚胎的孵化和发育过程中也没有表现出明显的胚胎毒性或致畸作用,胚胎孵化率、畸形率及形态均无显著变化。BHS也未造成小鼠死亡或体重明显下降,对肝肾功能也没有明显影响,凸显宝藿苷I金蓉颗粒的安全性。这意味着金蓉颗粒在体内具有较高的安全性。
四、患者福音,或改写乳腺癌治疗格局
宝藿苷I的发现为乳腺癌治疗带来了新的希望。目前,乳腺癌的治疗方法主要包括手术、化疗、放疗等,但这些方法都存在一定的局限性。手术只能切除肉眼可见的肿瘤,对于已经转移的癌细胞往往无能为力;化疗和放疗在杀死癌细胞的同时,也会对正常细胞造成损伤,导致一系列的副作用。
宝藿苷I作为一种天然的生物活性化合物,源自药食同源植物,长期服用无肝肾负担,具有独特的抗转移机制和高安全性,有望成为乳腺增生患者或成高风险人群预防及治疗的新选择。它既可单独使用,也能PD-1抑制剂、靶向药联用,可增强疗效,有望破解耐药难题,尤其适用于三阴性乳腺癌等难治性亚型。
宝藿苷I的发现也为中药抗癌研究提供了新的思路和方法。传统中药是一个巨大的宝库,其中蕴含着许多具有抗癌潜力的成分。通过现代科学技术的研究和发掘,我们可以从中药中提取出更多像宝藿苷I这样的有效成分,为癌症治疗做出更大的贡献,实现传统中药与现代科研的深度融合。
(本文内容源自公开发表的科学研究,用药请遵医嘱)
参考文献:Shengqi Wang,Neng Wang,Xiaowei Huang,Bowen Yang,Yifeng Zheng,Juping Zhang,Xuan Wang,Yi Lin,Zhiyu Wang. Baohuoside i suppresses breast cancer metastasis by downregulating the tumor-associated macrophages/C-X-C motif chemokine ligand 1 pathway[J]. Phytomedicine,2020,78..
关注我们:获取更多抗癌资讯与健康科普
来源: 奇绩金蓉


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 奇绩仟金方
奇绩仟金方 
