速看!国内著名医疗机构证实创新中药颗粒有效阻断乳腺癌肺转移!
乳腺癌是全球女性最常见的恶性肿瘤之一,其远处转移是影响临床预后的关键问题。肿瘤转移前微环境(PMN)是介导肿瘤转移的先决条件。TAMs/CXCL1信号通路可以刺激c-Kit+/Sca-1+ HSPCs(造血干/祖细胞)的补充和分化为CD11b+/Gr-1+ MDSCs(髓源性抑制细胞),这是促进PMN形成的象征性事件。PMN的形成是一个涉及多个器官、多种细胞和多个靶点的整体过程。
中医以其整体的观点来看待疾病的治疗和预防。大量研究表明,中药不仅可以通过杀死癌细胞来抑制肿瘤的生长和转移,而且可以改善肿瘤或远端器官的免疫抑制微环境。国家1类创新药金蓉颗粒(消癖颗粒,XPS)上市以来以安全、有效、独特的治疗优势应用于乳腺疾病治疗领域。乳腺癌一般来源于乳腺上皮细胞的失控增殖和乳腺导管增生,非典型增生被认为是乳腺恶性肿瘤的前兆。有研究表明金蓉颗粒可显著降低TAMs(肿瘤相关巨噬细胞)和MDSCs在肿瘤实质中的群落数量,通过TAMs/CXCL1通路抑制肿瘤干细胞的活性,将可能成为乳腺癌高风险人群患者的一级预防和二级预防的新手段。
关于肿瘤转移前微环境(PMN)的研究逐渐成为热点。发表于《Cell Communication and Signaling》一篇名为“XIAOPI formula inhibits the pre-metastatic niche formation in breast cancer via suppressing TAMs/CXCL1 signaling”的一项研究揭示了金蓉颗粒通过抑制TAMs/CXCL1信号通路预防乳腺癌PMN形成的作用及其分子机制。

图1 论文首页
一、金蓉颗粒体外抑制M2巨噬细胞极化及CXCL1表达
TAM巨噬细胞可被IL-4、TGF-β等诱导分化为M2表型。研究中首次用IL-4和IL-13在体外刺激RAW264.7使其进入M2表型,结果M1标记物iNOS水平下降、M2标记物ARG1水平上升,且M2抗原CD206比例升高(图2A)。进一步实验发现,金蓉颗粒对巨噬细胞M2表型RAW264.7的增殖有时间和剂量依赖性的抑制作用,反而对M1巨噬细胞增殖无明显抑制。结果显示金蓉颗粒对不同表型的巨噬细胞有选择性作用,而非一般免疫毒性(图2B)。
另外金蓉颗粒还能抑制M2表型巨噬细胞的极化(图2C),增加CD86表达,从而促进M2表型巨噬细胞的复极化,同时能够剂量依赖性抑制M2表型巨噬细胞CXCL1转录和表达(图2D、E),证明金蓉颗粒在体外可有效抑制TAMs/CXCL1信号转导。
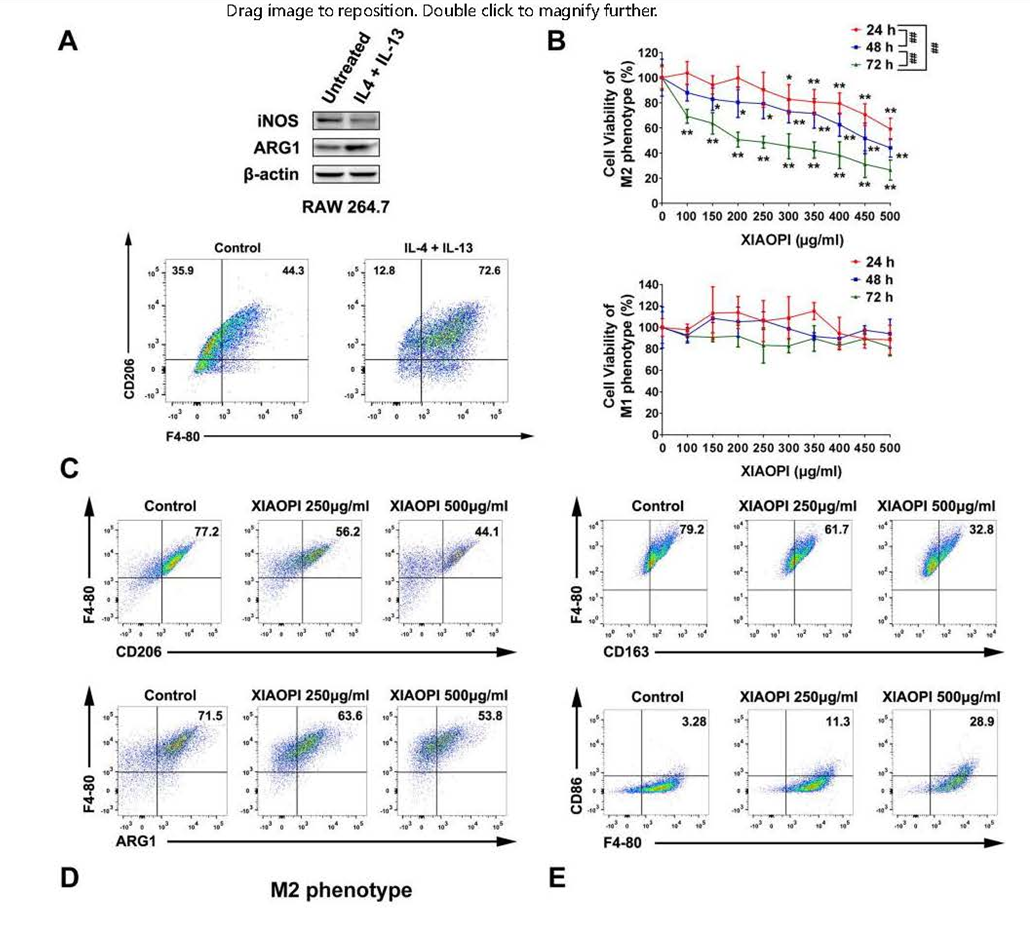
图2、金蓉颗粒抑制M2巨噬细胞极化及CXCL1表达
二、金蓉颗粒体外通过抑制TAMs/CXCL1抑制HSPCs募集和MDSCs分化
造血干细胞(HSPCs)对微环境形成有重要调节作用。以往的研究表明,HSPCs的募集和MDSCs的分化是介导PMN形成的重要前提。研究通过流式细胞仪检测CXCL1对HSPCs分化的影响,结果表明,CXCL1能逐渐增加HSPCs中CD11b+/Gr-1+ MDSCs的数量(图3B)。金蓉颗粒能够阻断TAMs诱导的HSPCs侵袭增强(图3C、D),同时能够阻断TAMs对于HSPCs分化为MDSCs的促进作用(图3E)。由于MDSCs被认为是促进PMN形成的必要因素,这些研究结果表明金蓉颗粒可能通过抑制HSPCs招募和MDSCs分化,从而抑制PMN形成。
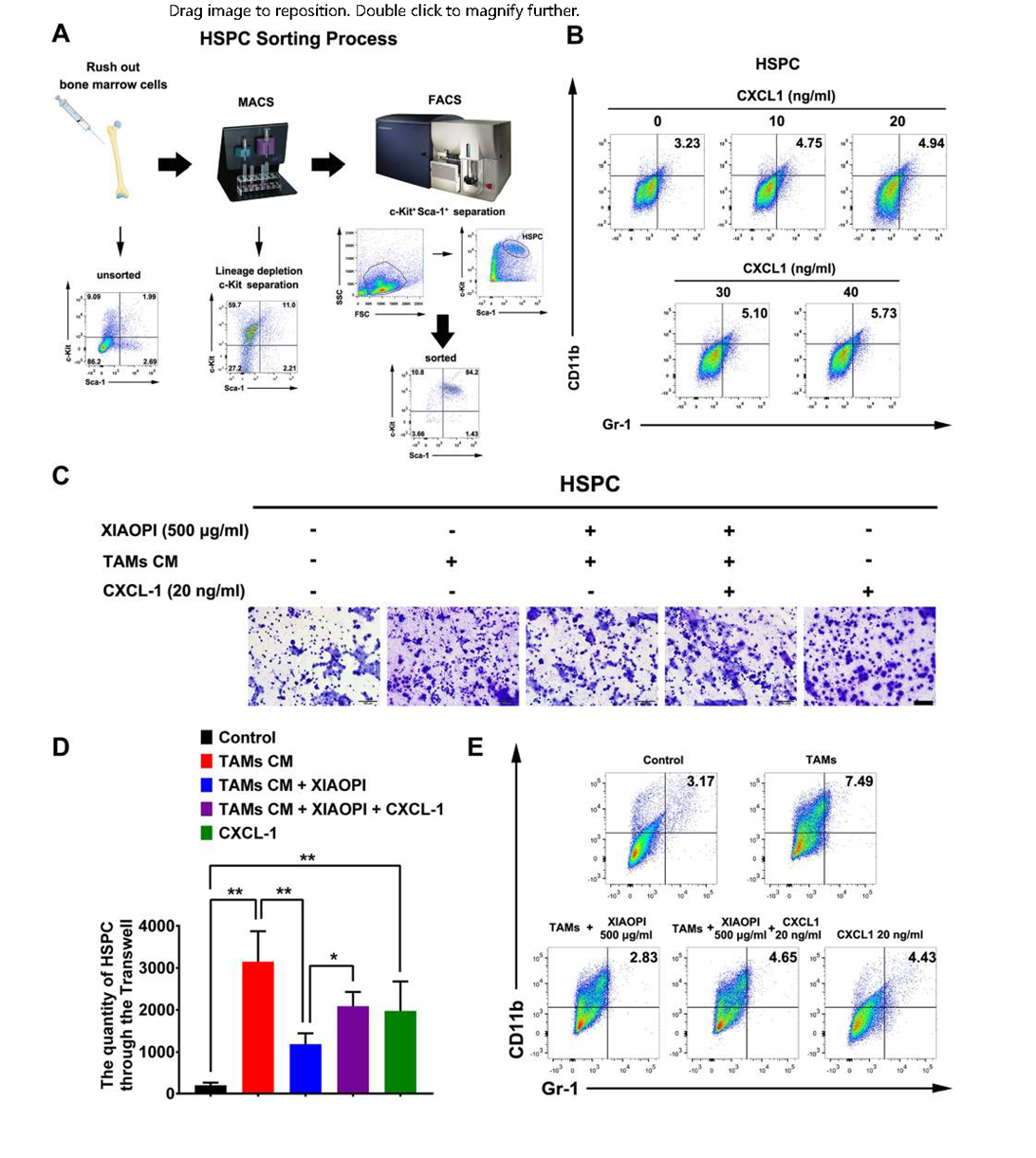
图3 金蓉颗粒通过抑制TAMs/CXCL1抑制HSPCs募集和MDSCs分化
三、金蓉颗粒抑制TAMs和HSPCs共培养的4T1细胞增殖和侵袭
上述研究表明,金蓉颗粒可能通过抑制MDSCs,阻断肿瘤免疫抑制微环境的形成。研究通过模拟肿瘤微环境(TME)验证金蓉颗粒对肿瘤细胞增殖和转移的影响,EdU细胞增殖实验和Transwell实验结果显示,TAMs能够显著增强HSPCs对肿瘤细胞或4T1细胞的增殖作用,金蓉颗粒或CXCL1中和抗体加入后可抑制这种促增殖作用,但CXCL1过表达能抵消该抑制(图4A、B)。此外金蓉颗粒还能抑制HSPCs诱导的MMP2和MMP9表达上调,从而减弱转移前微环境形成过程中的细胞外间质重构(图4C)。免疫荧光实验显示HSPCs促进了间充质细胞标记物Vimentin(波形蛋白)的表达,并下调了E-cadherin(钙黏蛋白E)的水平,金蓉颗粒能够通过抑制CXCL1抑制相关蛋白的表达及癌细胞的EMT(上皮-间质转化)过程(图4D)。可见,金蓉颗粒能抑制TME(肿瘤微环境)中癌细胞增殖和转移,抑制转移前微环境形成。
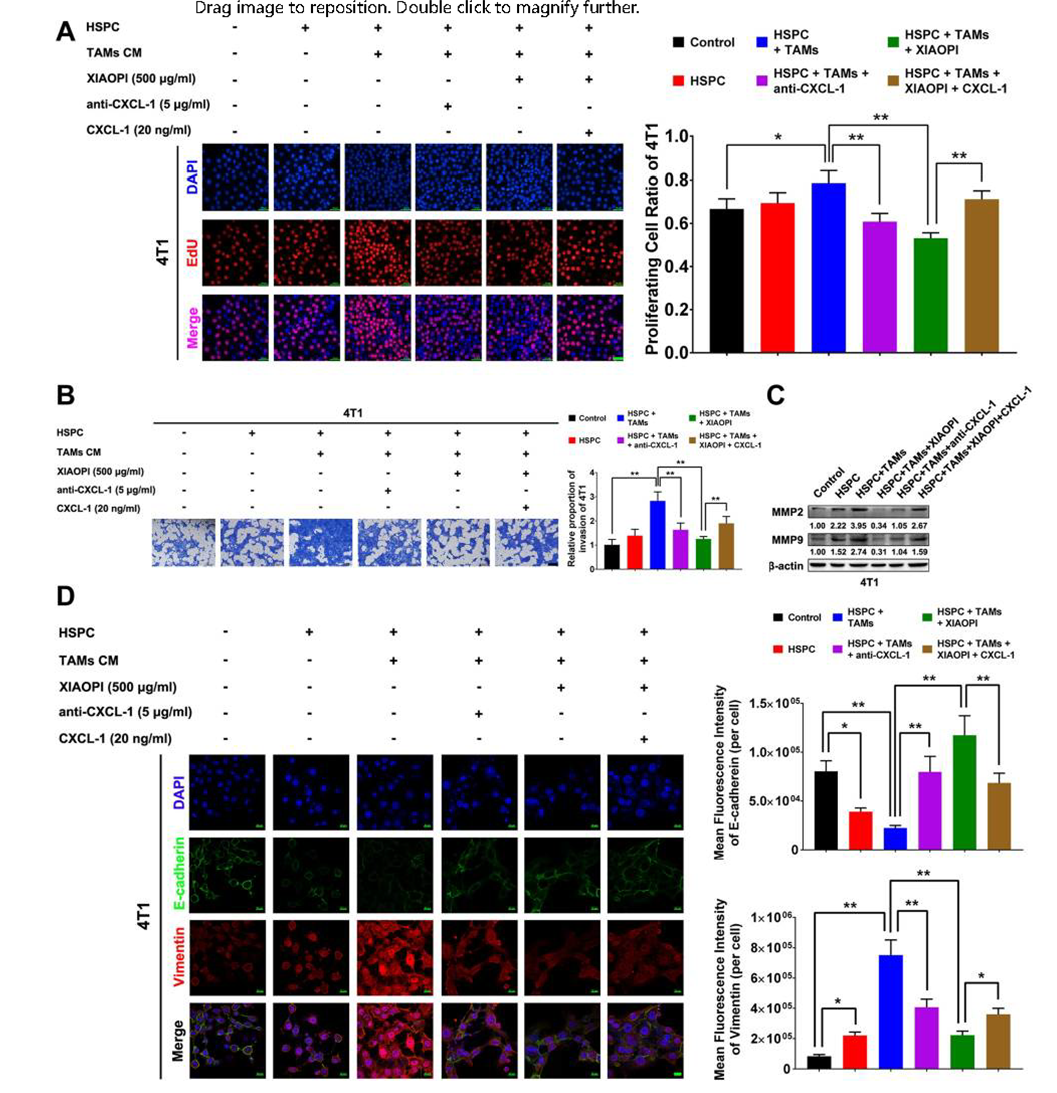
图4 金蓉颗粒抑制TAMs和HSPCs共培养的4T1细胞增殖和侵袭
四、金蓉颗粒体内抑制乳腺癌肺转移
为验证体外实验结论,研究将荧光素酶标记的4T1细胞注入BALB/c小鼠乳腺脂肪垫,评估金蓉颗粒体内抗转移效果(图5A)。结果显示金蓉颗粒能显著抑制肿瘤生长和抑制TAMs促癌作用,而CXCL1过表达会降低其抑制效果。荧光素酶显像实验表明,使用金蓉颗粒或敲除CXCL1基因能显著抑制TAMs诱导的癌细胞转移,而CXCL1过表达会消除其抗转移作用(图5E)。
此外,研究通过流式细胞仪检测消癖颗粒对肿瘤细胞比例的影响,结果显示金蓉颗粒能显著抑制肿瘤组织中F4-80+CD206+细胞和MDSCs的增殖,同时抑制肿瘤组织中的CXCL1基因表达(图5G),CXCL1过表达可逆转该抑制。这表明TAMs/CXCL1是金蓉颗粒抗癌和抑制转移的关键靶点之一。
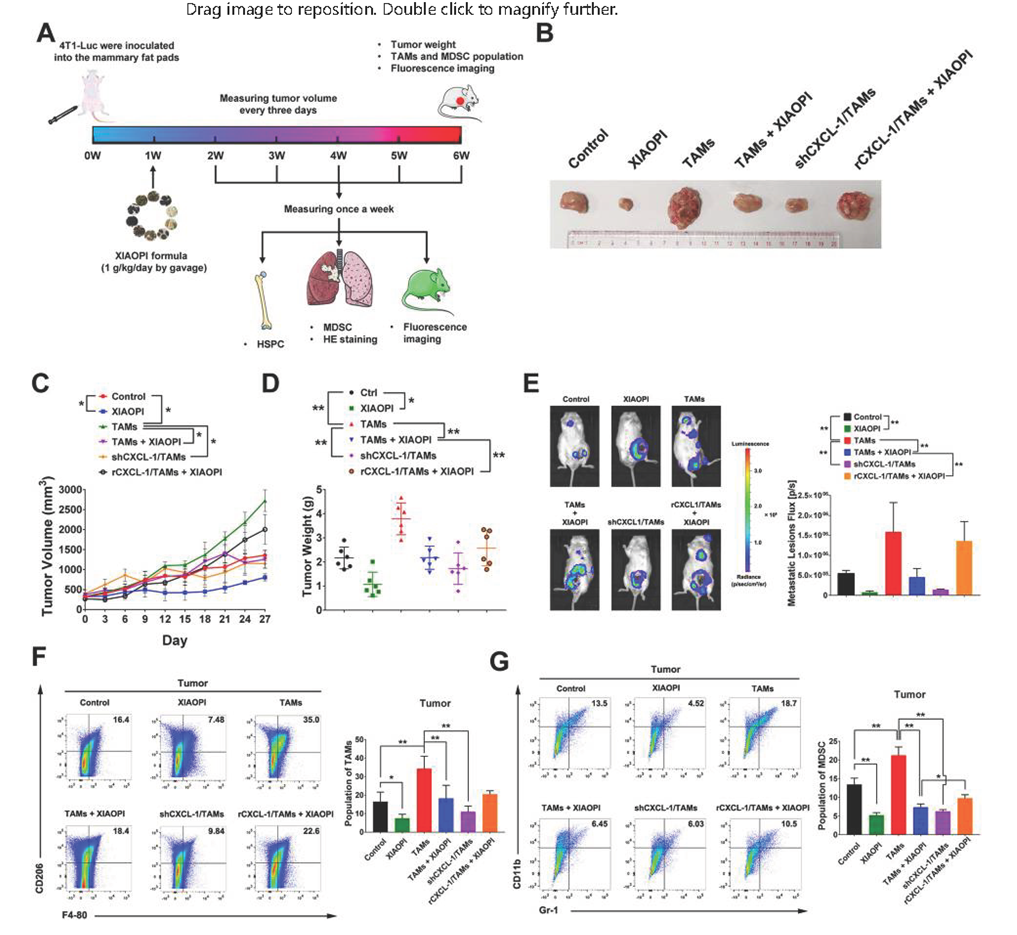
图5、金蓉颗粒抑制乳腺癌肺转移
五、金蓉颗粒体内通过抑制CXCL1介导的MDSCs激活抑制TAMs诱导的小鼠肿瘤微环境形成
PMN被认为是促进转移性病灶形成的必要条件。免疫荧光结果发现,使用金蓉颗粒或者敲除CXCL1基因,可明显阻断TAMS诱导的MDSCs积累和肿瘤细胞浸润,而CXCL1过度表达则会让金蓉颗粒的抑制效果“失效”。HE染色结果显示,金蓉颗粒能抑制肺微转移灶形成,进一步证实消癖颗粒能通过抑制PMN的形成而阻止肺转移(图6D)。TAMs/CXCL1信号通路是触发骨髓源性细胞的关键信使。
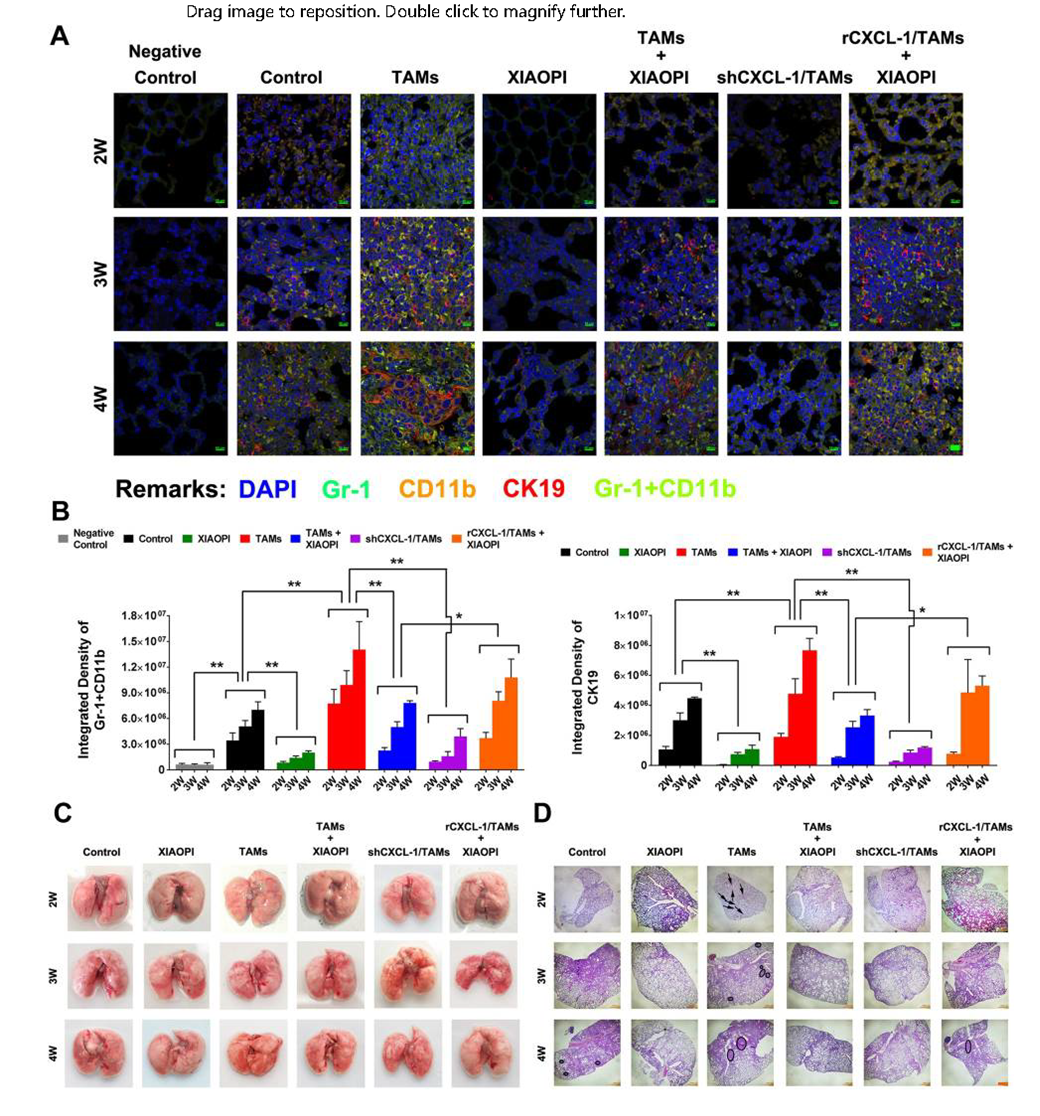
图6 金蓉颗粒通过抑制CXCL1介导的MDSCs激活抑制TAMs诱导的小鼠肿瘤微环境形成
六、金蓉颗粒体内抑制HSPCs招募和向MDSCs分化
以上结果表明,金蓉颗粒能抑制MDSCs在靶器官的活化和积累。研究结果发现金蓉颗粒对肿瘤细胞或TAMs诱导的HSPCs富集有明显的抑制作用,而CXCL1过表达会降低其抑制效果,进一步说明TAMs/CXCL1是金蓉颗粒抗PMN作用的关键信号传导途径(图7A、B)。
流式细胞仪分析结果显示,肺组织中MDSCs数量变化与HSPCs基本一致,与骨髓中HSPCs数量变化趋势一致。金蓉颗粒能抑制TAMs诱导的MDSCs增多,CXCL1过表达阻断金蓉颗粒颗粒的抑制作用。
结果显示金蓉颗粒不仅能抑制HSPCs的增殖和分化,而且没有明显的毒副作用,从而抑制转移前微环境的形成,防止乳腺癌转移。
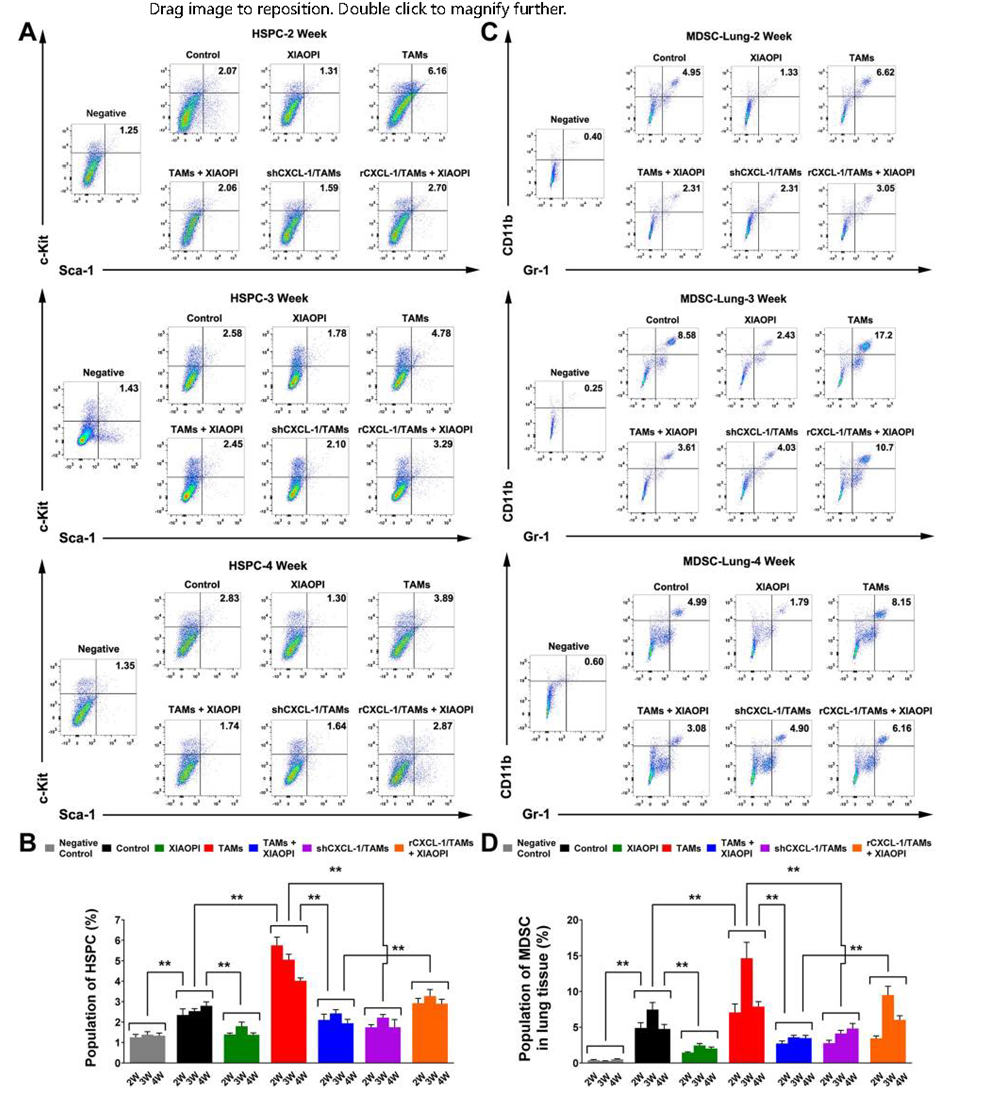
图7 金蓉颗粒抑制HSPCs招募和向MDSCs分化
研究表明金蓉颗粒能剂量依赖性地抑制M2极化和抑制CXCL1的mRNA和蛋白质表达,通过抑制TAMs/CXCL1信号转导,还能抑制TAMs/CXCL1诱导的HSPCs的募集和MDSCs的分化,可以阻止PMN的形成和肺转移。不仅提供了临床前证据支持金蓉颗粒应用于预防PMN形成,而且突出了TAMs/CXCL1在介导PMN建立中的新作用。
(本文内容源自公开发表的科学研究,用药请遵医嘱)
参考文献:Zheng Y, Wang N, Wang S, et al. XIAOPI formula inhibits the pre-metastatic niche formation in breast cancer via suppressing TAMs/CXCL1 signaling. Cell Commun Signal. 2020;18(1):48. Published 2020 Mar 26. doi:10.1186/s12964-020-0520-6
关注我们:获取更多抗癌资讯与健康科普!
来源: 奇绩金蓉


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 奇绩仟金方
奇绩仟金方 
